Optimierung von katalytischen Reaktionen durch Hochdruck-TGA
Frieder Dreisbach
March 28, 2022
Katalytische Reaktionen sind allgegenwärtig: von Kunststoffen und Brot bis hin zu über 90% aller Chemikalien weltweit werden unzählige Waren und Materialien mit Hilfe von Katalysatoren hergestellt.1 Katalysatoren sind Substanzen, die träge chemische Reaktionen beschleunigen. Schnellere Reaktionen sind technologisch und wirtschaftlich wettbewerbsfähiger. Darüber hinaus bieten optimierte Katalysatoren ein enormes Potenzial zur Reduzierung des Energie- und Ressourcenverbrauchs und zur Senkung der Kohlendioxidemissionen.
Heterogene Katalyse
In industriellen Anwendungen wird die Katalyse oder eine Reaktion unter Verwendung eines Katalysators entweder als , bei der sich der Katalysator in derselben (in der Regel flüssigen) Phase befindet wie der Reaktant, oder als heterogen, bei der häufig ein fester Katalysator mit fluiden (gasförmigen oder flüssigen) Reaktanten reagiert, klassifiziert.
Die heterogene Katalyse ist ein Grenzflächenprozess, d.h. dass die Größe der zugänglichen Katalysatoroberfläche die Reaktionsgeschwindigkeit beeinflusst. Bei der Mehrzahl der katalytisch aktiven Materialien handelt es sich um kleine Partikel mit einem großen Verhältnis von Oberfläche zu Masse, die mehr Reaktivität mit weniger Katalysator bieten.
Forscher:innen messen die Reaktionsgeschwindigkeiten unter Anwendungsbedingungen, um ihren Prozess zu optimieren und den maximalen Nutzen aus teuren Katalysatormaterialien zu ziehen. Mit leistungsstärkeren Katalysatormaterialien benötigen die Reaktionen weniger Katalysator und somit weniger Kosten, weniger Energieverbrauch und weniger natürliche Ressourcen für die Herstellung der Produkte.
Katalysatorprüfung durch Hochdruck-TGA
Die Hochdruck-Thermogravimetrische-Analyse (HP-TGA) ermöglicht es Forscher:innen, Reaktionen zwischen einem Katalysator und einem Reaktanten in der Gasphase unter realistischen Arbeitsbedingungen im Labormaßstab zu untersuchen. Zu den Reaktionsbedingungen können hoher Druck, hohe Temperatur, reaktive Gasgemische und Dampf gehören. Die Aktivierung und Deaktivierung eines Katalysators durch Oxidation, Reduktion oder Verkokung ist mit einer Gewichtsveränderung verbunden und kann bei der HP-TGA mit hoher Auflösung gemessen werden. Zugleich können die Ausbeute und die Kinetik der Reaktion durch Gasanalyse mit Online-Massenspektrometrie, Gaschromatographie, FTIR oder anderen Methoden überwacht werden. Diese Daten sind extrem nützlich, um die Reaktionsbedingungen zu optimieren und verbesserte Katalysatormaterialien zu entwickeln.
Das HP-TGA-Gerät kann als katalytischer Reaktor verwendet werden, während das Gewicht des Katalysators kontrolliert wird. Dieser Versuchsaufbau ermöglicht es den Forscher:innen, die Bedingungen, die katalytische Reaktionen und Veränderungen im Katalysatormaterial wie die Aktivierung oder die Deaktivierung auslösen, genau zu identifizieren. Die Reaktionsatmosphäre des HP-TGA kann aus üblichen reaktiven Gasen wie Wasserstoff, Methan, Ethan, Kohlendioxid oder Kohlenmonoxid und auch Dampf bestehen, und die Versuchsbedingungen können Temperaturen bis zu 1100°C und Drücke bis zu 80 bar abdecken.
Der größte Vorteil bei der Durchführung von katalytischen Gasphasenreaktionen an festen Katalysatoren in einem TGA-Gerät ist die Messung des Katalysatorgewichts während des Experiments, um Aktivierungs- oder Deaktivierungsprozesse des Katalysators kontinuierlich und quantitativ zu erfassen, während sie stattfinden.
Optimierung von Ertrag und Produktivität
Ein wesentlicher Faktor zur Verbesserung der Effizienz katalytischer Reaktionen ist die Auswahl der optimalen Betriebsbedingungen für eine bestimmte Reaktion. Die Produktkosten und der ökologische Fußabdruck lassen sich durch die Entwicklung katalytischer Prozesse mit alternativen Rohstoffen, die ebenfalls eine angepasste Prozesssteuerung erfordern, noch weiter reduzieren.2
Beispiel für die Optimierung der Katalysebedingungen: Die Methanisierung von Kohlendioxid ist ein Prozess, bei dem aus Kohlendioxid durch Reduktion mit Wasserstoff nach der Reaktionsgleichung CO2 + 4 H2 ↔ CH4 + 2 H20 Methan erzeugt wird. Wasserstoff aus erneuerbaren Energien kann so verwendet werden, um Kohlendioxid in grünes Methan umzuwandeln, das als Ausgangsstoff für die chemische Verarbeitung dient. Diese Reaktion ist von großer wirtschaftlicher Bedeutung als Schlüsselprozess im Rahmen des Power-to-Gas-Konzepts (PtG). In dem hier dargestellten Beispiel wird ein Nickelkatalysator mit Aluminiumoxidträger für die Methanisierungsreaktion in einer Reihe von katalytischen Experimenten mit einem Gasgemisch aus 2 % CO2, 8 % H2 und 90 % Ar verwendet. Die Druck- und Temperaturabhängigkeit der Reaktionsausbeute wurde bei unterschiedlichen Temperaturen zwischen 275°C und 350°C und bei 1,5 bar, 15 bar und 30 bar mit einem Online-MS überwacht. Abbildung 2 stellt die Methanausbeute bei allen drei Drücken gegenüber und überwacht die Massenspur m/z 15, die die Methankonzentration angibt, welche das Zielprodukt der Methanisierungsreaktion ist.
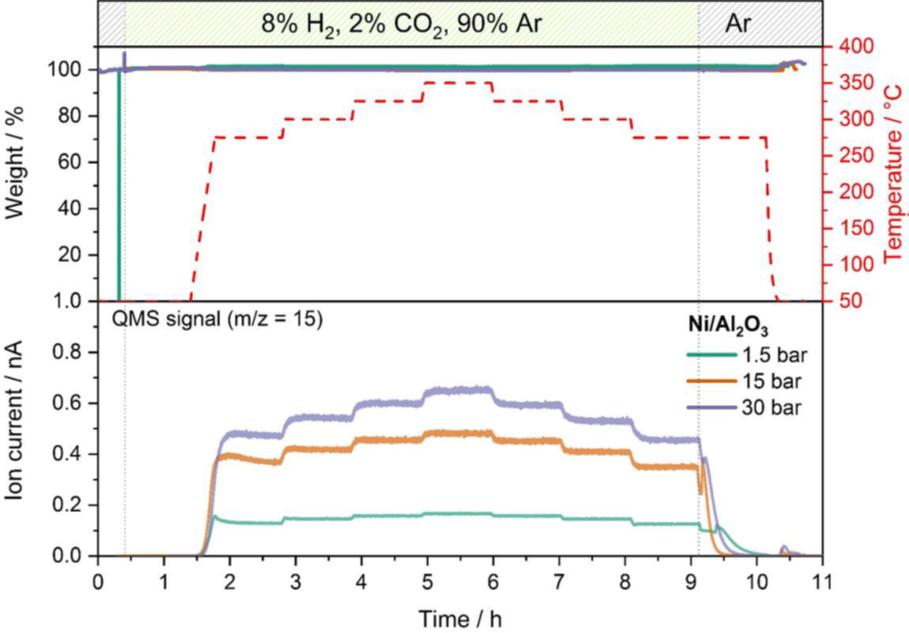
Der Vergleich der MS-Daten bei unterschiedlichen Drücken und Temperaturen zeigt, dass ein höherer Druck zu einer höheren Reaktionsausbeute führt. Der Temperatureinfluss auf die Ausbeute ist ähnlich, aber bei 15 und 30 bar stärker ausgeprägt als bei der Messung bei 1,5 bar. Es wurde bei keinem Druck eine Gewichtsveränderung des Katalysators festgestellt, was belegt, dass keine Deaktivierung oder Nebenreaktion stattgefunden hat.
Deaktivierung des Katalysators
Die Deaktivierung eines Katalysators ist der Verlust an katalytischer Aktivität oder Selektivität im Laufe der Zeit. Alle Katalysatoren deaktivieren sich mit der Zeit und müssen ersetzt werden. Die Betriebszeit bis zur Deaktivierung kann jedoch stark variieren: Sie hängt unter anderem von der Art des Katalysators, dem Prozess und der Einhaltung optimaler Betriebsbedingungen ab. Katalysatoren können sich innerhalb weniger Sekunden deaktivieren oder jahrelang planmäßig arbeiten.3 Für industrielle katalytische Prozesse stellt die Katalysatordeaktivierung ein großes wirtschaftliches Risiko dar. Das Abstellen von Prozessen und der Austausch von Katalysatoren kostet die chemische Industrie jedes Jahr Milliarden von Dollar.4
Es gibt übliche chemische, mechanische und thermische Mechanismen für die Deaktivierung von Katalysatoren, die in verschiedene Typen unterteilt werden können: z.B. Vergiftung, Verkokung oder Verschmutzung und Alterung.5, 6
Obwohl eine Deaktivierung des Katalysators in der Regel auf lange Sicht unvermeidlich ist, kann der Beginn einer vorzeitigen Deaktivierung häufig durch geeignete Maßnahmen zur Prozesskontrolle7 vermieden werden. Die Forschung und Entwicklung zielt darauf ab, robustere industrielle Prozesse und Katalysatormaterialien zu entwickeln.8 Dadurch kann die Deaktivierung verzögert und sogar umgekehrt werden.
Bewertung der Katalysatorverkokung
Die Deaktivierung von Katalysatoren aufgrund von Koksbildung ist ein bedeutendes technologisches und wirtschaftliches Problem bei der Erdölraffination und in der petrochemischen Industrie. Eine verbesserte Resistenz von Katalysatoren gegen Verkokung lässt sich durch die Verwendung von anderen katalytisch aktiven Metallen und/oder die Anpassung der Reaktionsbedingungen wie Temperatur, Druck oder Gaszusammensetzung erreichen. Die Material- und Prozessoptimierung für die Koksbildung verlangt die Messung der Deaktivierungskinetik des Katalysators unter realen Reaktionsbedingungen.9
Beispiel für die Messung der Verkokung: Nachfolgend wird eine Dampfreformierungsreaktion bei 700°C und 10 bar dargestellt. Die Reaktionsatmosphäre setzt sich aus Argon, Methan und Dampf mit einem Verhältnis von Dampf zu Methan von 4:1 zusammen. Unter diesen Bedingungen wird die Wasserstofferzeugung durch Online-MS nachgewiesen, wobei das Gewicht des Katalysators konstant bleibt. Um den Beginn der Verkokung zu ermitteln, wird das Verhältnis von Dampf zu Methan auf 1:1 und später auf 1:2 geändert, indem der Methan- und Dampfdurchsatz angepasst wird. Abbildung 3 veranschaulicht das Katalysatorgewicht und das Verhältnis von Dampf zu Methan im Laufe der Zeit.
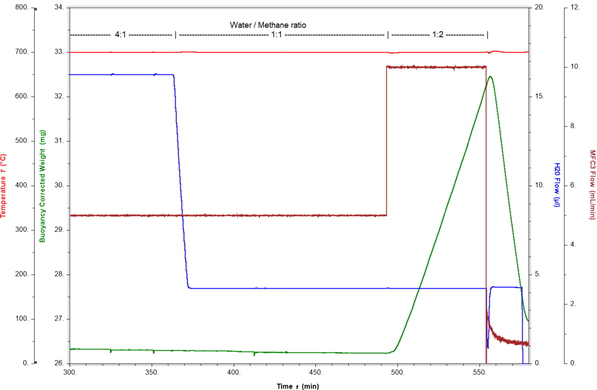
Bei einem Verhältnis von Dampf zu Methan von 4:1 und 1:1 ist das Katalysatorgewicht stabil. Wenn das Verhältnis auf 1:2 geändert wird, bewirkt der Überschuss an Methan sofort eine schnelle Gewichtszunahme von 0,3 %wt/min. Diese Gewichtszunahme wird durch die Bildung von Koks (elementarem Kohlenstoff) auf dem Katalysator verursacht. Dieser Verkokungsprozess kann rückgängig gemacht und der Katalysator regeneriert werden, indem der Methanfluss abgeschaltet wird. Der Dampf oxidiert nun den Koks, was zu einer schnellen Gewichtsverlustrate von 0,9 %(wt)/min führt. In lediglich 15 Minuten werden mehr als 4 mg Koks von der Katalysatoroberfläche entfernt. Dies belegt die Umkehrbarkeit des Prozesses, wenn die Reaktionsbedingungen schnell genug angepasst werden. Abbildung 4 zeigt, dass die Verkokung zu beachtlichen Mengen an gebildetem Kohlenstoff führen kann, wenn die Reaktionsbedingungen nach Beginn der Koksbildung nicht schnell geändert werden.

Eine optimierte Katalyse ist nur ein Experiment entfernt
Wie die oben genannten Beispiele und Techniken zeigen, kann die Katalyse durch die Auswahl des besten Katalysators und der Reaktanten, die Optimierung der Reaktionsbedingungen und die Vermeidung, Verzögerung oder Umkehrung der Deaktivierung verbessert werden. Verbesserte katalytische Reaktionen bieten mehr Nachhaltigkeit bei geringeren Kosten.
Die Hochdruck-TGA ist eine der führenden Methoden zur Untersuchung der Katalysatorleistung und zur Optimierung heterogener katalytischer Reaktionen. Gasphasenreaktionen wie Methanisierung, Dampfreformierung und viele andere technisch und kommerziell wichtige Reaktionen lassen sich in einem HP-TGA-Gerät unter den entsprechenden Bedingungen von Druck, Temperatur und Gas- oder Dampfzusammensetzung durchführen. Der Reaktionsumsatz lässt sich durch EGA-Analyse mit Massenspektrometrie, FTIR oder anderen geeigneten Methoden überwachen und das Katalysatorgewichtssignal liefert wertvolle Online-Daten über Aktivierungs- und Deaktivierungsprozesse.
Möchten Sie mehr über die Möglichkeiten der TGA zur Optimierung von katalytischen Materialien und Prozessen erfahren? Lesen Sie bitte unseren Anwendungshinweis zu diesem Thema oder sehen Sie sich die aufgezeichneten Webinare zu TGA unter extremen Bedingungen oder zur Optimierung von Katalysatoren mit TGA-Methoden an. Zögern Sie nicht, sich mit den Expert:innen von TA Instruments in Verbindung zu setzen, um Ihren Testbedarf zu besprechen und das ideale Instrumentarium für Ihr Labor zu finden.
Quellennachweise:
- Ma, Z. and Zaera, F., Heterogeneous Catalysis by Metals, in King, R. Bruce; Crabtree, Robert H.; Lukehart, Charles M.; Atwood, David A. (eds.), Encyclopedia of Inorganic Chemistry, John Wiley & Sons, Ltd.
- Anderson, N., (2000), Practical Process Research & Development, Optimizing Catalytic Reactions, 185-201.
- Bartholomew, C.H., Mechanisms of catalyst deactivation, Applied Catalysis A: General 212 (2001) 17–60.
- Boskovic G., Baerns M. (2004), Catalyst Deactivation, in: Baerns M. (eds) Basic Principles in Applied Catalysis. Springer Series in Chemical Physics, vol 75. Springer, Berlin, Heidelberg.
- Figuerido, J.L. (Ed.), Progress in Catalyst Deactivation, NATO Advanced Study Institute Series E, Marunus Nijhoff, Boston, 1982.
- Hughes, R., Deactivation of Catalysts, Academic Press, London, 1984 (Chapter 8).
- Oudar, J. and Wise, H., Deactivation and Poisoning of Catalysts, Marcel Dekker, New York, 1985, 1.
- Butt, J.B., Petersen, E.E., Activation, Deactivation, and Poisoning of Catalysts, Academic Press, San Diego, 1988.
- Wolf, E. E. and Alfani, F., (1982), Catalysts Deactivation by Coking, Catalysis Reviews, 24:3, 329-371

