Produkte | Mikrokalorimeter | RS-DSC von TA Instruments
RS-DSC von TA Instruments
Die nächste Generation der Prüfung der Thermostabilität biologischer Arzneistoffe
Das RS-DSC von TA Instruments ist ein völlig neues, leistungsstarkes und vielseitiges Instrument für die Prüfung der Thermostabilität biologischer Arzneistoffe. Das RS-DSC von TA Instruments ermöglicht hocheffiziente biopharmazeutische Analysen und dadurch die schnellere Entwicklung eines neuen Präparats bis zur Marktreife.

Das RS-DSC von TA Instruments ermöglicht
- Schnellere Prüfung der Thermostabilität: Das RS-DSC von TA Instruments liefert durch die gleichzeitige Analyse von bis zu 24 Proben deutlich schneller detaillierten Aufschluss über die Thermostabilität von Arzneistoffen. Darüber hinaus verfügt das RS-DSC von TA Instruments über die erforderliche Technologie zur Charakterisierung selbst hoch konzentrierter Arzneistoffe.
- Verbesserte Effizienz: Das RS-DSC von TA Instruments gewährleistet eine effiziente Materialnutzung durch die Verwendung von Mikrofluidik-Chips (Micro Fluidic Chips, MFCs) für den Einmalgebrauch zur Aufnahme der Probe. Mikrofluidik-Chips erfordern ein Probenvolumen von weniger als15µl und sorgen für saubereres, effizienteres Arbeiten, indem sie die Notwendigkeit mühsamer Probenverdünnung, wiederholter Gerätereinigung und Kontaminationsrisiken reduzieren.
- Datengestützte Entscheidungen: Die NanoAnalyze™ Software bewältigt mühelos das von dem RS-DSC von TA Instruments erzeugte erhöhte Datenvolumen und liefert detaillierte, präzise Einblicke in die thermische Stabilität und die thermodynamischen Eigenschaften eines Moleküls.

Bahnbrechende Neuerungen
- Erhöhter Durchsatz: Das RS-DSC von TA Instruments ermöglicht die gleichzeitige Analyse von 24 Proben, was den Erhalt von Forschungsdaten und die Entwicklung biologischer Therapeutika bis hin zur Marktreife erheblich beschleunigt.
- Ressourceneffizienz: Die minimalen Anforderungen an das Probenvolumen des RS-DSC von TA Instruments tragen dazu bei, eine maximale Materialnutzung zu gewährleisten und die Kosten zu minimieren.
- Messung hoher Konzentrationen: Das RS-DSC von TA Instruments ermöglicht insbesondere die effiziente und effektive Prüfung auch sehr hochkonzentrierter Arzneistoffe.
- Vereinfachter Arbeitsablauf: Das RS-DSC von TA Instruments sorgt für effiziente Abläufe, indem es die Notwendigkeit einer Probenverdünnung bei hochkonzentrierten Proben überflüssig macht; die Mikrofluidik-Chips für den Einmalgebrauch reduzieren den Reinigungsaufwand bzw. machen eine Reinigung komplett überflüssig und verringern das Kontaminationsrisiko.
- Umfassende Datenanalyse: Die NanoAnalyze-Software verwaltet Daten und liefert detaillierte Informationen zur Optimierung der Entwicklung.
Eigenschaften und Vorteile
- Parallele Analyse: Die spezielle Hochdurchsatzanalyse ermöglicht bis zu 24 gleichzeitige Messungen für schnellere Forschungsdaten.
- Mikrofluidik-Technologie zum Einmalgebrauch: Mikrofluidik-Chips sorgen für mehr Effizienz, indem sie die Charakterisierung hochkonzentrierter Arzneistoffe vereinfachen und den Reinigungsaufwand sowie das Kontaminationsrisiko reduzieren.
- State-of-the-Art-Software zur Datenanalyse: Die robuste und benutzerfreundliche NanoAnalyze-Software analysiert Daten automatisch und konsistent für eine detaillierte und schnelle Auswertung.
| RS-DSC | |
| Geometrie der Zelle | Einwegzelle, Mikrofluidik |
| Zellenmaterial | Glas |
| Probenformat | Mikrofluidik-Chips |
| Arbeitsvolumen der Zelle | 11 µl |
| Probenkapazität | 24 Mikrofluidik-Chips |
| Typische Probenkonzentration | 20 mg/ml – 330+ mg/ml IgG (proteinabhängig)1 |
| Probendurchsatz | > 96 Proben/Tag |
| Temperaturbereich | 20 °C –100 °C |
| Temperatur-Scanrate | 1 °C/min oder 2 °C/min |
| Temperaturgenauigkeit | ± 0,2 °C (alle Kalorimeter); ± 0,1 °C Reproduzierbarkeit2 |
2 Verwendung von DPPC in Wasser bei pH 7 bei 1 °C/min. beschleunigen Sie Ihre Forschung, verbessern Sie die Effizienz und treffen Sie fundiertere Entscheidungen mit dem RS-DSC von TA Instruments, einem revolutionären neuen Hochdurchsatzgerät für thermische Stabilitätstests, das speziell für die Entwicklung biologischer Arzneimittel entwickelt wurde.
Technologie
Bahnbrechende Neuerungen
Mikrofluidik-Technologie: Die Zukunft von Präzision und Bedienfreundlichkeit
Das RS-DSC von TA Instruments ist mit modernsten Mikrofluidik-Chips ausgestattet und ermöglicht ein bequemes Laden den Proben. Diese Technologie macht eine wiederholte Reinigung der Messzelle des Instruments zwischen den Analysen überflüssig, was Zeit spart, das Kontaminationsrisiko verringert und präzisere und zuverlässigere Messwerte ermöglicht.
Die Mikrofluidik-Chips sind für den Einmalgebrauch bestimmt und erleichtern die Bedienung, ermöglichen schnelle Übergänge und schützen das Instrument vor gefährlichen Substanzen. Das neuartige Design der für den Einmalgebrauch ausgelegten Mikrofluidik-Chips spiegelt modernste Technologie wider, erfordert ein geringes Probenvolumen und erleichtert das Laden und Vorbereiten von Proben mit Standard-Laborgeräten. Eine Probe kann in weniger als einer Minute vorbereitet, verschlossen und zur Analyse bereitgestellt werden, sodass für eine präzise Beurteilung bereits kleinste Mengen ausreichen.
Produktdemonstration ansehen
Anwendungen
Das RS-DSC von TA Instruments ermöglicht eine Vielzahl von Anwendungen in der Entwicklung von Biotherapeutika, zum Beispiel:
Die thermische Stabilität ist eine Eigenschaft, die für den allgemeinen klinischen Erfolg eines biologischen Arzneistoffs ausschlaggebend ist. Vor diesem Hintergrund ist die dynamische Differenzkalorimetrie (Differential Scanning Calorimetry, DSC) eine der wichtigsten Methoden zur Charakterisierung der Auswirkung der Lösungsumgebung auf die Proteinstabilität. Auswirkungen auf die Proteinstabilität können sich in kleinen Verschiebungen des Tmax oder auch in zweistelligen Temperaturänderungen widerspiegeln, die aus veränderten Variablen wie pH-Wert, Puffer, Ionenstärke, Hilfsstoffen und Detergenzien resultieren.
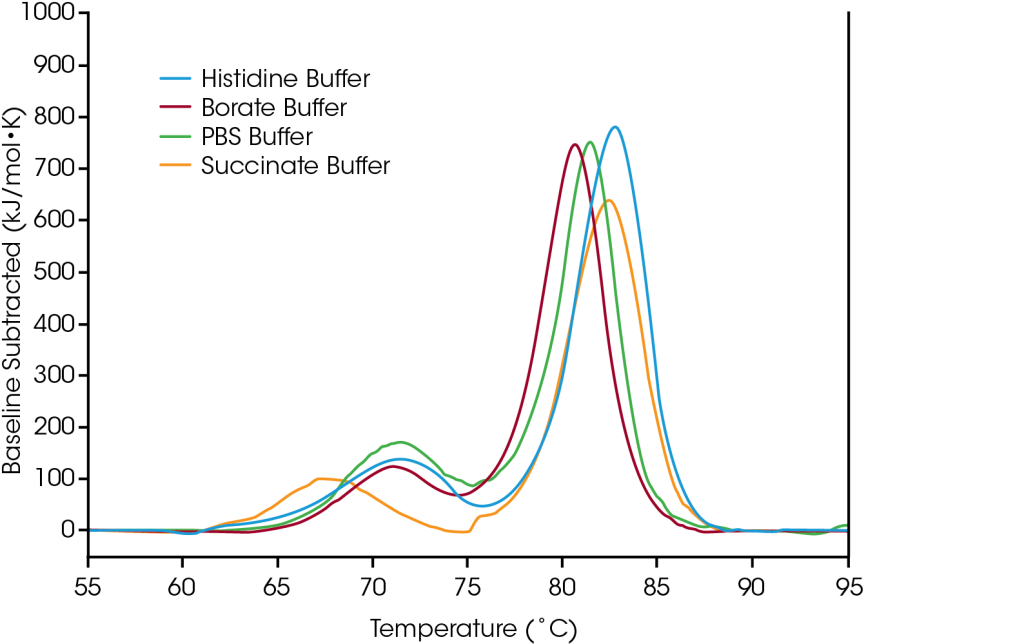
Um zu zeigen, wie die Daten aus dem Formulierungsscreening bei der Auswahl von Pufferkomponenten helfen können, wurde der Antikörper Trastuzumab unter vier gängigen Pufferbedingungen getestet: 1) in einem gängigen Arbeitspuffer (PBS), 2) in einem Lysin-Konjugationspuffer für die Synthese markierter Antikörper für Studien des zellulären Transports oder der Wirkstoffkonjugation (Borat), 3) als auf Trastuzumab basierendes Antikörper-Wirkstoffkonjugat (Succinat) und 4) mit dem nativen Formulierungspuffer für Trastuzumab (Histidin).
Das erste Auffaltungsereignis, die Auffaltung der CH2-Domäne, wird durch den Histidin-, den Borat- oder den Arbeitspuffer nicht wesentlich beeinflusst. Allerdings destabilisiert der Succinatpuffer die CH2-Domäne, was zu einer Verringerung der Temperatur zum Beginn der Auffaltung und des Tmax,1 um ca. 3°C führt. Was den Hauptübergang anbelangt, die Fab- und CH3-Auffaltungsereignisse, wirken der Histidin- und der Succinatpuffer mit einem Tmax,2 von 82,66°C am stärksten stabilisierend. Der Hauptübergang ist in Boratpuffer am wenigsten stabil bei einem Tmax,2 von 80,69°C. Wenig überraschend ist die Pufferformulierung mit der stärksten stabilisierenden Wirkung für Trastuzumab in diesem Probensatz der Histidinpuffer, der auch für die fertige Darreichungsform des zugelassenen Arzneimittels verwendet wird.
Proteinmutationen sind eine gängige Methode zur Optimierung der Proteinstruktur und -funktion, und selbst Modifikationen einzelner Aminosäuren können einen messbaren Einfluss auf die Gesamtstabilität des Proteins haben. Der Einsatz der dynamischen Differenzkalorimetrie bei der Charakterisierung von gentechnischen Modifikationen von Proteinen ist für das Verständnis der strukturellen Auswirkungen der Mutation auf das Protein als Ganzes von entscheidender Bedeutung und kann Entscheidungshilfen für die Entwicklung biologischer Arzneistoffe liefern. Um die Auswirkungen einer Sequenzmodifikation auf die Stabilität zu demonstrieren, wurde eine kleine Gruppe gentechnisch veränderter Proteine auf Veränderungen der thermischen Stabilität untersucht, die aus einzelnen Aminosäuremutationen in der Proteinsequenz resultieren.
Im Ausgangsprotein erfolgt die Auffaltung innerhalb eines primären thermischen Übergangs bei einem Tmax von 75,92°C. Eine Aminosäuremutation hatte keinen wesentlichen Einfluss auf die kurzfristige thermische Stabilität (Mutation 1); andere Mutationen einzelner Aminosäuren hatten wiederum erhebliche Auswirkungen auf die Stabilität des Proteins (Mutation 2 und Mutation 3). Wie die erhebliche Destabilisierung von Mutation 3 zeigt, hat eine Modifikation nicht immer die gleiche Wirkung; eine Rolle spielen sowohl der Ort der Modifikation als auch die physikalisch-chemischen Eigenschaften der neuen Aminosäure. Die Optimierung der gewünschten funktionellen Vorteile der Sequenzmodifikation über die strukturelle Stabilität des Proteins als Ganzes trägt zum Verständnis der Struktur-Funktions-Beziehung bei und kann der Entwicklung neuartiger Therapeutika erleichtern.
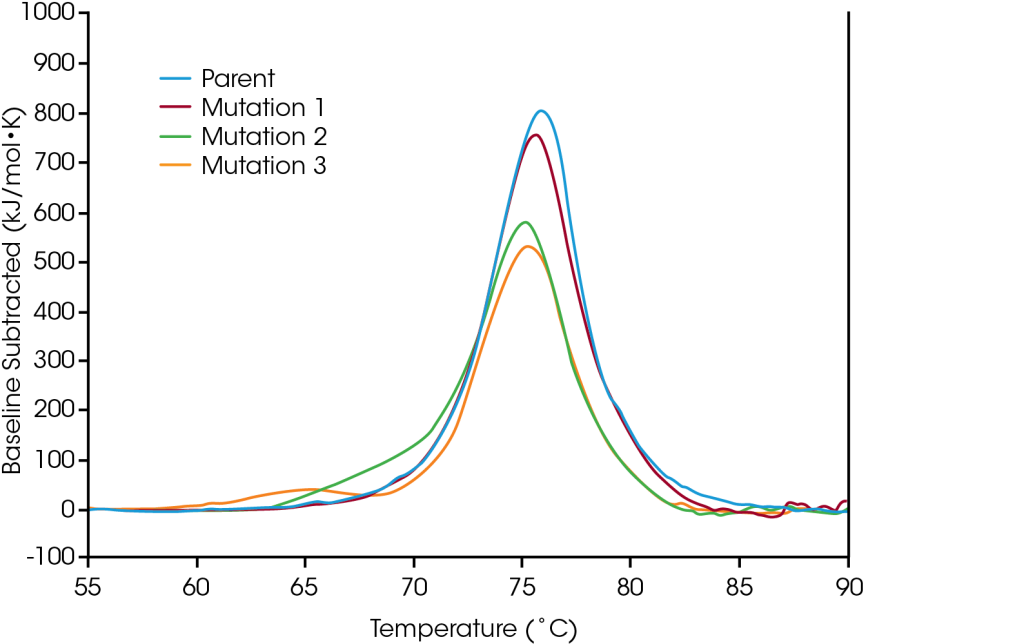
Das RS-DSC von TA Instruments ist speziell für die Analyse hochkonzentrierter biologischer Arzneistoffproben konzipiert, insbesondere von Antikörper-Arzneistoffen und Antikörper-Arzneistoff-Konjugaten. Bedingt durch den zunehmend erfolgreichen Einsatz von Antikörpertherapeutika herrscht in der Pharmaindustrie Interesse an hochkonzentrierten Dosierungsformen, die eine subkutane und okulare Arzneimittelabgabe ermöglichen. Daher sind Formulierungen mit Konzentrationen von 50 mg bis 150 mg Antikörper pro Milliliter nicht ungewöhnlich, teilweise sogar mit einem Gehalt von 200 mg/ml und mehr. Die Formulierung von Proteinen in hohen Konzentrationen kann die Anfälligkeit für physikalische Instabilität erhöhen. Umgekehrt haben einige Fallstudien eine Verbesserung der thermischen Stabilität bei erhöhten Konzentrationen gezeigt. Daher ist das Verständnis der thermisch bedingten Auffaltung und der Reaktion auf die Lösungsumgebung bei der jeweiligen Formulierungskonzentration eine entscheidende Messgröße für die Minderung der Arzneimittelhaftung.
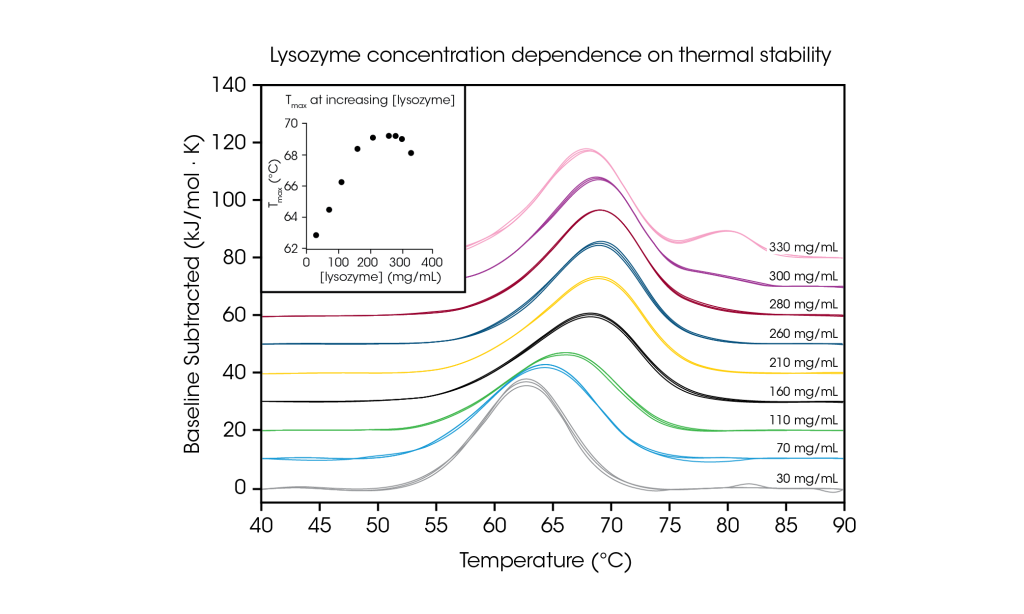
Zur Veranschaulichung der Prüfung hochkonzentrierter Proteinproben und der Bedeutung einer solchen Prüfung bei der gewünschten Formulierungskonzentration wurde Hühnereiweiß-Lysozym von 30 bis 330 mg/ml in Glycinpuffer analysiert. Mit seinem einfachen Single-Transition-Thermogramm bei niedrigen Konzentrationen (~1 mg/ml) wird Lysozym häufig als Referenztestprobe in der dynamischen Differenzkalorimetrie verwendet. Durch die Analyse von Proteinkonzentrationen, die bis zu 100-fach höher waren, wurde eine Konzentrationsabhängigkeit der Lysozymstabilität festgestellt.
Ressourcen
- Anwendungshinweis: Rapid Thermal Stability Screening of High Concentration Biologic Drugs
- Anwendungshinweis: Rapid Thermal Stability Screening and Selection of Monoclonal Antibody Drug Products
- Anwendungshinweis: Rapid Thermal Stability Screening of Oligonucleotides Using the TA Instruments RS-DSC
- Produktdemonstration: Einführung in die RS-DSC: Eine verdünnungsfreie Methode zum Screening der thermischen Stabilität von hochkonzentrierten Biotherapeutika
- Webinar: Accelerate Your Research with High-Throughput DSC: Introducing the TA Instruments™ Rapid Screening DSC








