Keywords: DSC, MDSC, Lithium-Ionen-Batterie, Elektrolyte, niedrige Temperatur
TA468-DE
Abstract
Elektrolyte in Lithium-Ionen-Batterien müssen in flüssigem Zustand bleiben, um einen optimalen Ionentransport und eine optimale Batterieleistung zu gewährleisten. Das Verständnis des Phasenübergangs von Elektrolyten ist entscheidend für die Verbesserung der Leistung von Batterien bei niedrigen Temperaturen, insbesondere in kälteren Klimazonen. Die dynamische Differenzkalorimetrie (Differential Scanning Calorimetry, DSC) bietet eine einfache Messung zur Bewertung der Kristallisation und des Schmelzens von Elektrolyten. Hochkonzentrierte Elektrolyte können unterkühlt werden und bleiben bei schneller Abkühlung flüssig, was beim Erhitzen zur Kristallisation führt. Die daraus resultierende Kaltkristallisation und das Schmelzen können sich im gleichen Temperaturbereich überschneiden, was mit einem herkömmlichen Experiment der dynamischen Differenzkalorimetrie nicht vollständig analysiert werden kann. Bei der modulierten dynamischen Differenzkalorimetrie wird die Kristallisation in ein nicht umkehrbares Wärmestromsignal und das Schmelzen in ein umkehrbares Wärmestromsignal aufgeteilt. Dies ermöglicht eine klare und genaue Integration der mit der Kristallisation und dem Schmelzen verbundenen Enthalpie, was weitere Einblicke in den Mechanismus des Phasenübergangs über einen Temperaturbereich ermöglicht. In dieser Arbeit werden zwei handelsübliche Elektrolyte untersucht, um die Übergänge bei niedrigen Temperaturen zu verstehen, die sich auf die Batterieleistung auswirken können.
Einführung
Elektrolyte in Lithium-Ionen-Batterien ermöglichen den Ionenfluss zwischen Kathode und Anode, um die Batterie zu laden und zu entladen. Eine zentrale Herausforderung besteht darin, eine hohe Energiedichte zu erreichen und gleichzeitig die Stabilität und Langlebigkeit unter verschiedenen Betriebsbedingungen zu erhalten. Die Elektrolytformulierung enthält ein Salz, am häufigsten LiPF6, in einer wässrigen oder organischen Lösung [1]. Ethylencarbonat (EC), Ethylmethylcarbonat (EMC) und Dimethylcarbonat (DMC) werden häufig verwendet, können aber bei höheren Spannungen aufgrund von Oxidation eingeschränkt sein. Die Zugabe von Additiven zur Formel ermöglicht eine hohe Spannung und begrenzt gleichzeitig die Konzentration von Ethylencarbonat, was dem Betrieb bei niedrigen Temperaturen zugutekommt [2] [3].
Eine häufige Beschwerde über Lithium-Ionen-Batterien ist die Abnahme der Effizienz bei kalten Temperaturen. Wenn der Elektrolyt gefriert, wird der Ionentransport reduziert und die Leistung der Batterie beeinträchtigt. Die Analyse von Elektrolyten zur Identifizierung von Phasenübergängen bei niedrigen Temperaturen ist ein wertvolles Werkzeug für die Formulierung und hilft bei der Vorhersage der Batterieleistung unter Betriebsbedingungen. Die dynamische Differenzkalorimetrie bietet eine einfache Methode zur Messung der Wärmeflussänderung während des Phasenübergangs eines Materials. Mit der Discovery DSC von TA Instruments können Sie herkömmliche Tests der dynamischen Differenzkalorimetrie und Tests der modulierten dynamische Differenzkalorimetrie (MDSC) durchführen, um die Phasenübergänge der Elektrolyte zu verstehen, wie z. B. Kristallisations- und Schmelztemperaturen und Phasenübergangsenthalpien.
Die herkömmliche dynamische Differenzkalorimetrie misst den Wärmefluss als Funktion der linear ansteigenden Temperatur in einer Probe. Die modulierte dynamische Differenzkalorimetrie bietet einen zusätzlichen Einblick in einen herkömmlichen Test der modulierten dynamischen Differenzkalorimetrie, indem sie eine sinusförmige Modulation auf eine durchschnittliche Heizrate anwendet [4] [5]. Das Umkehrsignal in der modulierten dynamischen Differenzkalorimetrie ist die Reaktion des Wärmeflusses auf die Heizrate und misst die Wärmekapazität, Änderungen der Wärmekapazität und das Schmelzen der Kristalle. Das nicht umkehrbare Signal misst die Reaktion des Wärmestroms auf die absolute Temperatur und Zeit und erfasst kinetische Prozesse wie Kristallisation, Zersetzung, Verdampfung, molekulare Entspannung und chemische Reaktionen. Die Fähigkeit, komplexe Übergänge aus Messungen der modulierten dynamischen Differenzkalorimetrie in spezifische Komponenten aufzulösen, verbessert die Interpretation der Daten. In diesem Hinweis wird ein dynamisches Differenzkalorimeter von TA Instruments verwendet, um sowohl herkömmliche als auch Messungen der modulierten dynamischen Differenzkalorimetrie von Elektrolyten von Lithium-Ionen-Batterien durchzuführen, um den Phasenübergang in Abhängigkeit von der Temperatur zu verstehen.
Versuchsaufbau
Zwei Arten von kommerziellen Elektrolyten wurden von SpectraPower (Livermore, CA) bereitgestellt und werden in dieser Studie als Elektrolyt A und Elektrolyt B bezeichnet. Mit einem dynamischen Differenzkalorimeter von TA Instruments mit Tzero-Technologie wurde das Wärmestromsignal während der Erwärmung und Abkühlung der Elektrolytproben gemessen. Proben von etwa 10 mg wurden in einem Handschuhbeutel vorbereitet und in einer hermetischen Tzero-Schale versiegelt. Die Proben wurden zunächst auf -120 °C abgekühlt und dann mit 10 °C/min von -120 °C auf 40 °C gebracht, um das Gefrieren und Schmelzen des Elektrolyten zu untersuchen. Der Beginn und der Höhepunkt der Kristallisations- und Schmelztemperaturen wurden gemessen, ebenso wie die Enthalpie des Phasenübergangs.
Die modulierte dynamische Differenzkalorimetrie wurde mit der modulierten Nur-Wärme-Methode (siehe Tabelle 1) mit einer Modulationsdauer von 60 s und einem Heizanstieg von 2 °C/min von -120 °C auf 40 °C durchgeführt.
Tabelle 1. Modulierte dynamische Differenzkalorimetrie Moduliertes Nur-Wärme-Verfahren
| Test | Moduliertes Nur-Wärme-Verfahren |
|---|---|
| Modulationszeitraum | 60 sec |
| Anlaufgeschwindigkeit | 2 °C/min |
| Starttemperatur | -120 °C |
| Endtemperatur | 40 °C |
Ergebnisse und Diskussionen
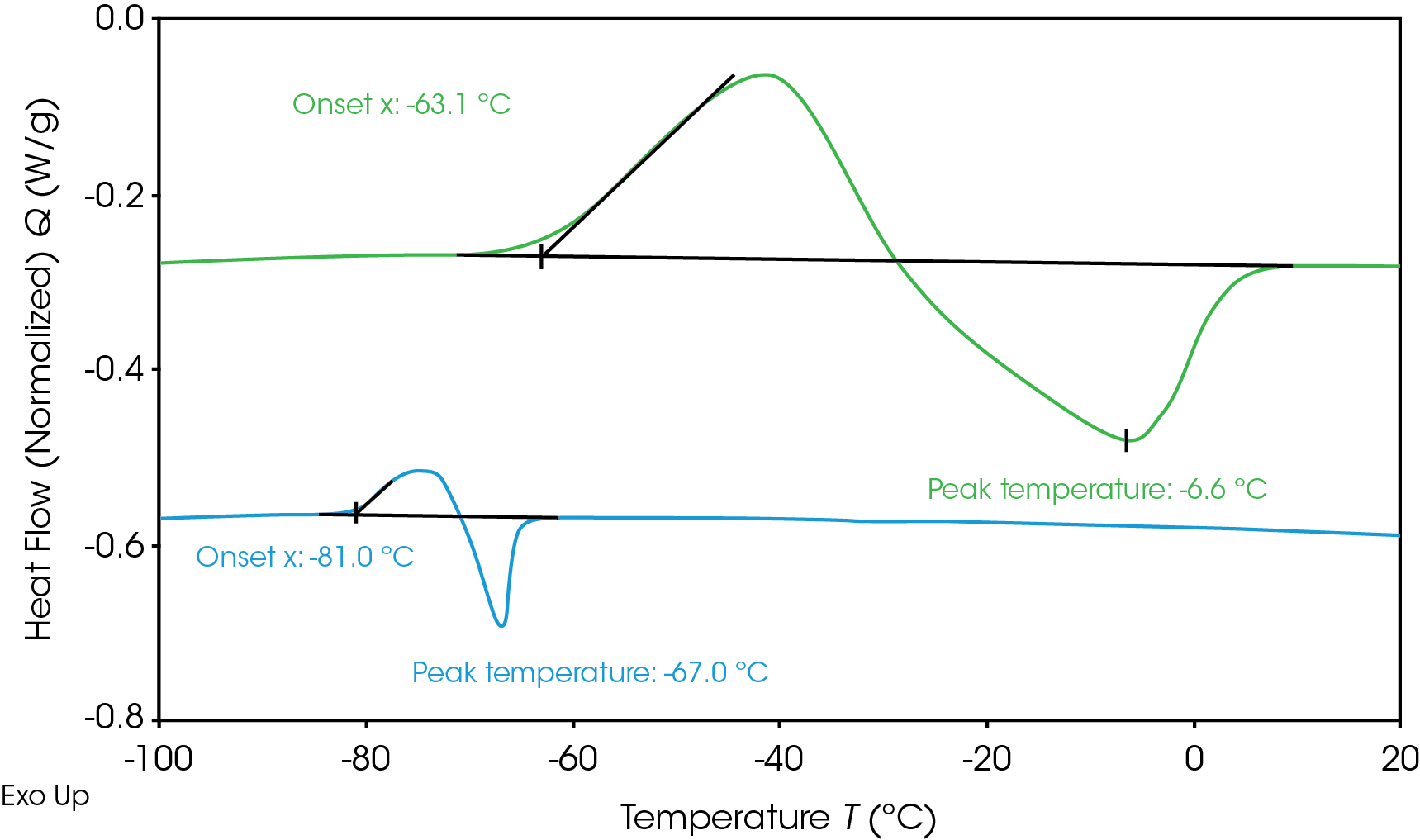
Die Bestimmung von Elektrolyt-Phasenübergängen trägt dazu bei, das Einfrieren von Batterien bei kalten Temperaturen zu verhindern. Der mittels dynamischer Differenzkalorimetrie gemessene Wärmefluss der Elektrolyte während des Einfrierens und Auftauens ist in Abbildung 1 dargestellt. Die Elektrolyte wurden auf -120 °C abgekühlt und dann aufgeheizt, um den Phasenübergang zu messen. Keiner der beiden Elektrolyte kristallisierte während des Abkühlens, was zu einer unterkühlten Lösung führte; beide kristallisierten jedoch beim Erwärmen (kalte Kristallisation) [6]. Elektrolyt A (grün) zeigt einen Kristallisationsbeginn bei -63,1 °C und einen Schmelzpunkt bei -6,6 °C. Elektrolyt B (blau) zeigt einen niedrigeren Kristallisationsbeginn bei -81 °C und eine Schmelzspitze bei -67 °C. Die niedrigere Schmelztemperatur ist für den Betrieb bei kälteren Temperaturen wünschenswert, da der Elektrolyt in einem größeren Temperaturbereich flüssig bleibt. Wenn der Elektrolyt gefriert und kristallisiert, ist die Beweglichkeit der Lithium-Ionen eingeschränkt, was die Leistung der Batterie beeinträchtigt. Es können Anpassungen an der Elektrolytformulierung vorgenommen werden, um den Gefrierübergang zu beeinflussen, oder am Wärmemanagementsystem, um zu verhindern, dass die Batterie die Anfangstemperatur des Gefrierpunkts erreicht.
Der überlappende Übergang, den Elektrolyt A während des Gefrierens und Schmelzens erlebt, kann durch modulierte dynamische Differenzkalorimetrie besser verstanden werden. Bei der modulierten Nur-Wärme dynamischen Differenzkalorimetrie sinkt die modulierte Temperatur nie ab und die Probe wird nie abgekühlt, um zu verhindern, dass die Abkühlung die Kristallisation beeinflusst [7]. Durch modulierte dynamische Differenzkalorimetrie wurde der überlappende Kristallisations- und Schmelzübergang (Abbildung 1) getrennt, um die Kristallisation bei nicht umkehrenden und das Schmelzen bei umkehrenden Wärmeflusssignalen zu unterscheiden (Abbildung 2). Die Trennung ermöglicht eine klare Integration der mit der Kristallisation und dem Schmelzen verbundenen Enthalpie. Die resultierende Kristallisationsenthalpie von Elektrolyt A beträgt 28,8 J/g und die Schmelzenthalpie 28,8 J/g, was darauf hinweist, dass die gesamte Kristallinität während der kalten Kristallisation beim Erhitzen gebildet wurde. Die langsame Heizrate von 2 °C/min, die bei der modulierten dynamischen Differenzkalorimetrie im Vergleich zur herkömmlichen dynamischen Differenzkalorimetrie mit 10 °C/min verwendet wird, verbessert ebenfalls die Auflösung und zeigt einen zusätzlichen Kristallisationspeak bei -63,7 °C und -52,7 °C. Das Schmelzen erfolgte unmittelbar nach der Hauptkristallisation und erreichte seinen Höhepunkt bei -5,6 °C.
Der in Abbildung 3 gezeigte Elektrolyt B weist zwei separate Kristallisations- und Schmelzspitzen auf. Wie bei Elektrolyt A weist die ähnliche Gesamtkristallisationsenthalpie (21,3 J/g) und Gesamtschmelzenthalpie (21,3 J/g) von Elektrolyt B darauf hin, dass das gesamte kristalline Material während der Kaltkristallisation beim Erhitzen gebildet wurde. Die Gesamtenthalpien können für die weitere Bewertung des Kristallisations- und Schmelzmechanismus des Elektrolyten B in zwei Teile getrennt werden.
Die TRIOS-Software kann die Integration über die Funktion „Spitzenwert teilen“ analysieren, um jede regionale Enthalpie und den prozentualen Anteil an der Fläche anzuzeigen, wodurch ersichtlich wird, wie viel der individuellen Enthalpie während jedes Kristallisations- und Schmelzereignisses aufgetreten ist. Wie in Tabelle 2 zu sehen ist, ist die Gesamtenergie für das Schmelzen und die Kristallisation zwar gleich, aber die Enthalpie für die erste Kristallisation (14,9 J/g) und die folgende Schmelze (12,8 J/g) sind nicht gleich. Die anschließende Kristallisation (6,5 J/g) erfolgt und folgt auf ein endgültiges Schmelzen (8,5 J/g). Dies deutet auf eine heterogene Kristallisation und Schmelzung der Materialien hin. Über die Temperatur des Prozesses hinweg gibt es verschiedene Phasen bei einer bestimmten Temperatur und diese Analyse gibt Einblick in den Mechanismus des Phasenübergangs.
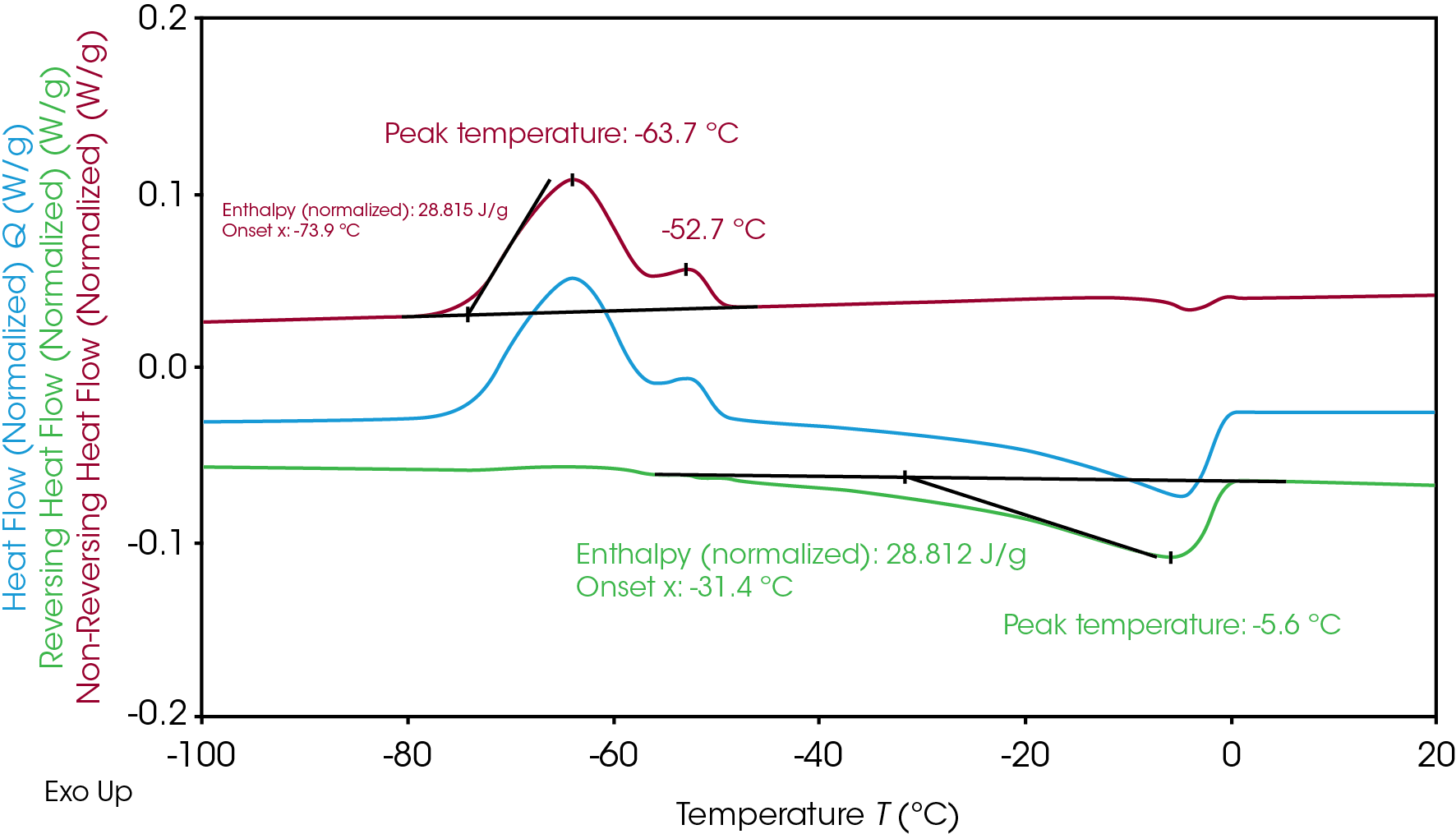
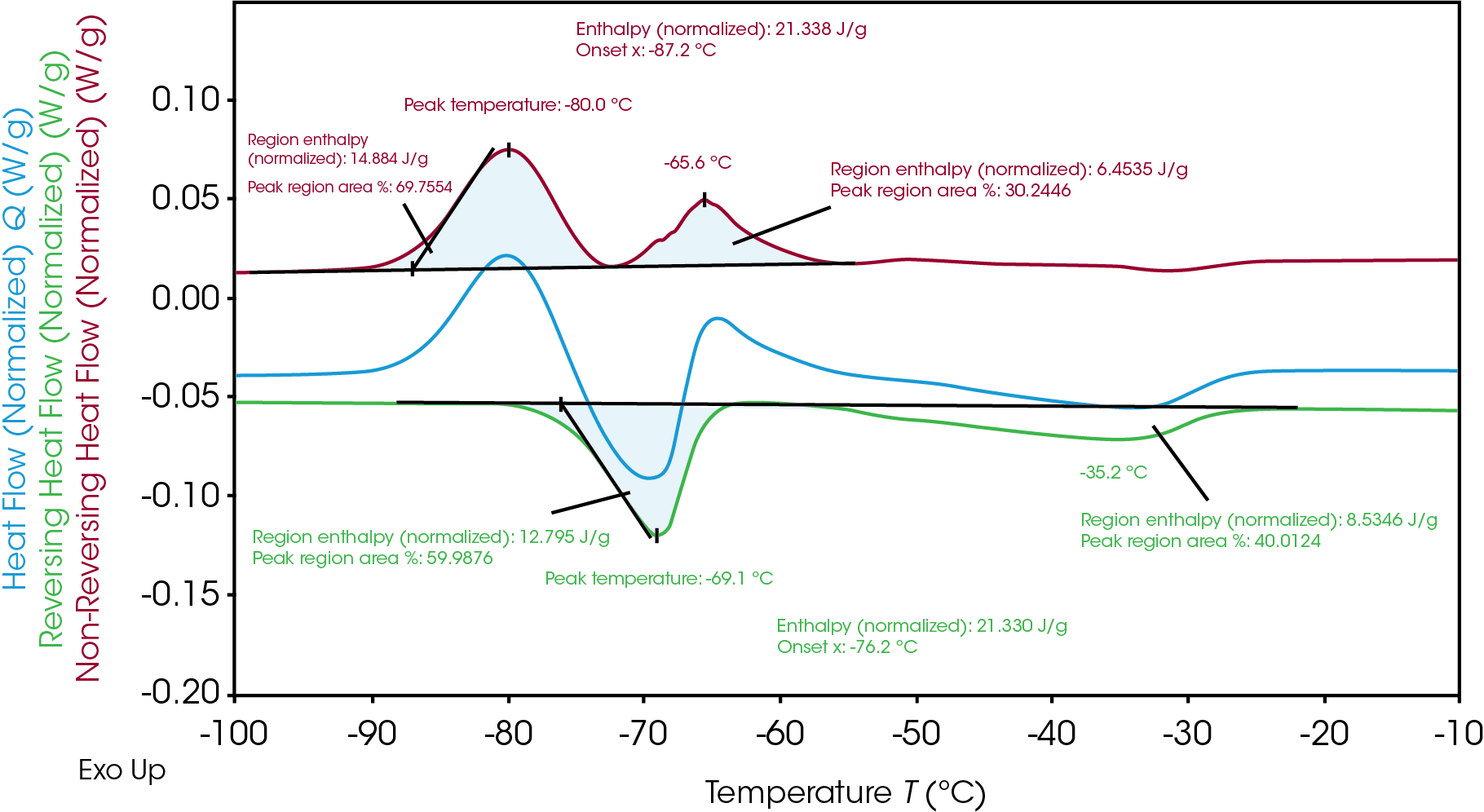
Tabelle 2. Aufschlüsselung der Kristallisations- und Schmelzenthalpien von Elektrolyt B
| Spitzentemperatur (°C) | Enthalpie (J/g) | Wärmefluss-Signal | |
|---|---|---|---|
| 1. Kristallisation | -80.0 | 14.9 | Nicht umkehrbar |
| 1. Schmelzen | -69.1 | 12.8 | Umkehrbar |
| 2. Kristallisation | -65.6 | 6.5 | Nicht umkehrbar |
| 2. Schmelzen | -35.2 | 8.5 | Umkehrbar |
Fazit
Das Verständnis der Phasenübergänge von Elektrolyten ist entscheidend für die Leistung von Lithium-Ionen-Batterien bei niedrigen Temperaturen. Die Differential-Scanning-Kalorimetrie misst den Wärmefluss von Elektrolyten und kann zur Bestimmung der Anfangstemperaturen von Gefrier- und Schmelztemperaturen verwendet werden. Die modulierte dynamische Differenzkalorimetrie bietet den Vorteil, dass Kristallisations- und Schmelzübergänge, die manchmal im gleichen Temperaturbereich stattfinden, getrennt werden können. Mit dieser Technik können Forscher neue Formulierungen zur Verbesserung der Batterieleistung bei niedrigen Temperaturen untersuchen und Hersteller können eine dynamische Differenzkalorimetrie zur Qualitätskontrolle von Elektrolyten einsetzen.
Literaturhinweise
-
- H. Yang, G. V. Zhuang and P. N. Ross Jr., “Thermal Stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6,” Journal of Power Sources, vol. 161, pp. 573-579, 2006.
- E. R. Logan, E. M. Tonita, K. L. Gering, L. Ma, M. K. G. Bauer, J. Li, L. Y. Beaulieu and J. R. Dahn, “A Study of the Transport Properties of Ethylene Carbonate-Free Li Electrolytes,” Journal of the Electrochemical Society, vol. 165, no. 3, 2018.
- O. Lavi, S. Luski, N. Shpigel, C. Menachem, Z. Pomerantz, Y. Elias and D. Aurbach, “Electrolyte Solutions for Rechargeable Li-Ion Batteries based on FLuorinated Solvents,” ACS Applied Energy Materials, vol. 3, pp. 7845-7499, 2020.
- L. C. Thomas, “TP006 Modulated DSC® Paper #1: Why Modulated DSC®? ; An Overview and Summary of Advantages and Disadvantages Relative to Traditional DSC,” TA Instruments, New Castle, DE.
- TA Instruments, “TN34 Thermal Applications Note: Modulated DSCTM: A Simple Technique With Significant Benefits,” TA Instruments, New Castle, DE.
- L. A. Robertson, Z. Li, Y. Cao, I. A. Shkrob, M. Tyagi, K. C. Smith, L. Zhang, J. S. Moore and Y. Z, “Observation of Microheterogeneity in Highly Concentrated Nonaqueous Electrolyte Solutions,” Journal of the American Chemical Society, vol. 141, no. 20, pp. 8041-8046, 2019.
- TA Instruments, “TN045: Choosing Conditions in Modulated DSC®,” TA Instruments, New Castle, DE.
Danksagung
Diese Notiz wurde von Jennifer Vail, PhD und Hang Lau, PhD bei TA Instruments geschrieben.
Hier klicken, um eine Druckversion dieses Anwendungshinweises herunterzuladen.

