Arbeitsabläufe und Techniken bei der Entwicklung von Biopharmaka
Julienne Regele | Calliste Scholl | Morgan Ulrich
November 27, 2023
Die Arzneimittelentwicklung ist ein langer und komplexer Prozess, der mit der Wirkstoffforschung beginnt und im Erfolgsfall mit der behördlichen Genehmigung für das Inverkehrbringen endet. In jedem Schritt des Arzneimittelentwicklungs-prozess, der im Folgenden beschrieben wird, gibt es konkrete Zielsetzungen, mit denen letztendlich der am besten geeignete Kandidat zur Herstellung eines zugelassenen Arzneimittelwirkstoffs ausgewählt wird.
In diesem Artikel werden die maßgeblichen Ziele und Techniken behandelt, die in jeder Phase der Entwicklung von Antikörpermedikamenten verwendet werden.
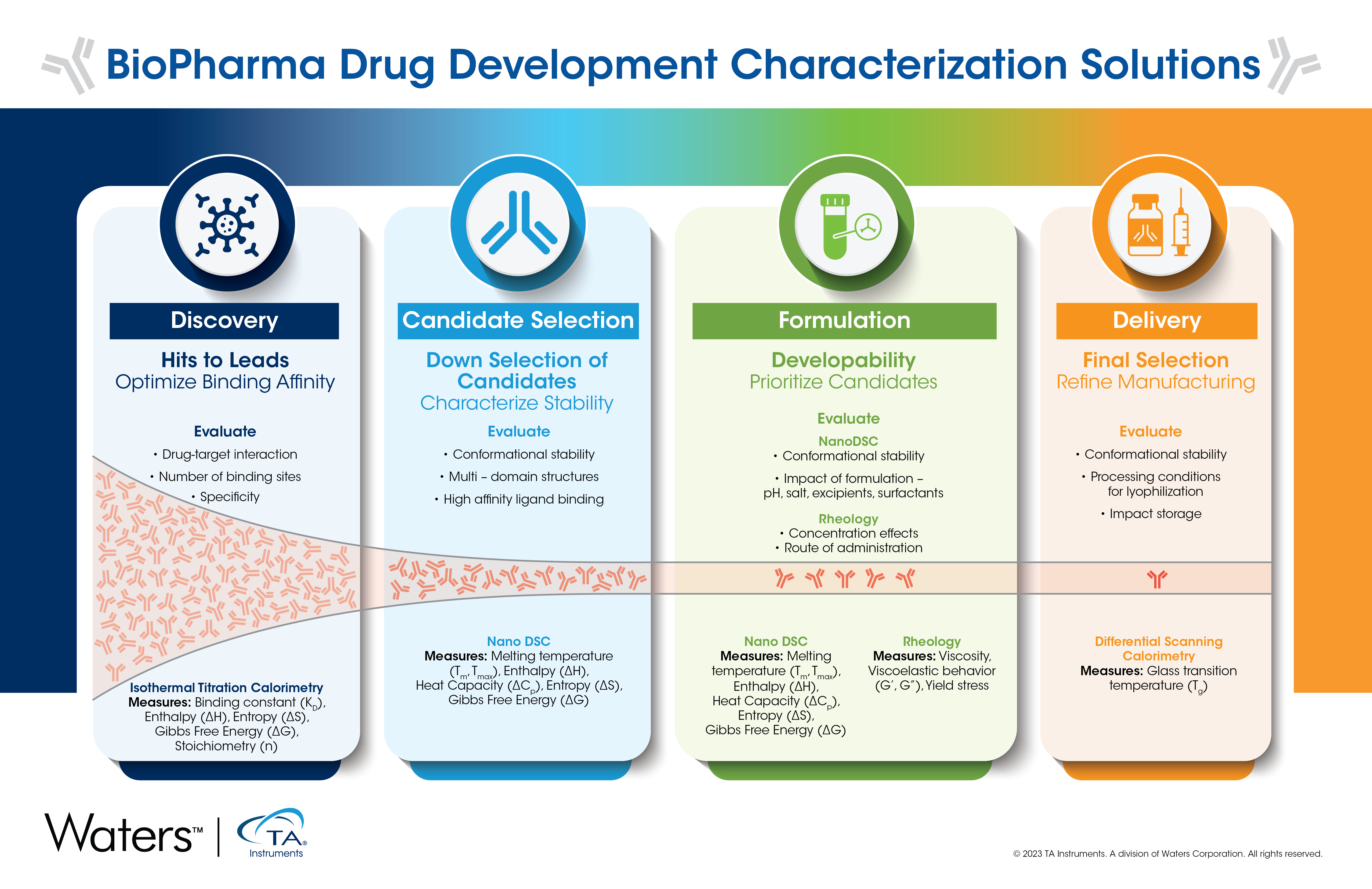
Wirkstoffforschung
In der Phase der Wirkstoffforschung gibt es eine Früh- und eine Spätphase. Das Hauptziel dabei besteht darin, jede Sequenz mit unerwünschter Leistung zu entfernen, sowohl unter Berücksichtigung chemischer Instabilitäten als auch der Bindung an die Zielstruktur. Am Anfang des Prozesses steht ein großes Panel aus Hunderten bis Tausenden von Antikörpern, das dann auf wenige Dutzend reduziert wird. Um das Panel zu verkleinern, wird häufig das In-silico-Screening eingesetzt, da die Probenverfügbarkeit zu diesem Zeitpunkt sehr gering ist. Beim In-silico-Screening werden Computersimulationen oder virtuelle Screening-Tools verwendet, um Vorhersagen über das Verhalten verschiedener Moleküle zu treffen.1 Die Sequenz wird analysiert, um das Risiko von „Hotspots“ zu minimieren, die die Entwicklungsfähigkeit später im Prozess beeinträchtigen könnten. Nachdem der Pool eingegrenzt wurde, wird die Antigenbindung charakterisiert, um sicherzustellen, dass der Antikörper an das identifizierte Ziel bindet und auch die gewünschte Wirksamkeit wieder erreicht wird, mit dem primären Ziel, die Anzahl der Antikörper zur weiteren Charakterisierung zu reduzieren.
Präformulierung
In dieser Phase wurde die Anzahl der Antikörper während des Selektionsprozesses bereits auf wenige Dutzend reduziert. Während der Präformulierung ist es wichtig sicherzustellen, dass die Tests unter stabilen Bedingungen durchgeführt werden. Das bedeutet, dass möglicherweise ein gewisses Maß an Puffer-Screening erforderlich ist. Allerdings wird dieser Puffer wahrscheinlich nicht mit dem Puffer in der endgültigen Formulierung identisch sein. Es ist wichtig, die verbliebenen Antikörper vollständig zu charakterisieren, beginnend mit der Validierung von eingangs durchgeführten Bindungsstudien mittels isothermer Titrationskalorimetrie (Isothermal Titration Calorimetry, ITC).
Die isotherme Titrationskalorimetrie ist eine marker- und immobilisierungsfreie Methode zur Charakterisierung von Bindungsinteraktionen. Sie liefert umfangreiche Informationen, nicht nur darüber, ob eine Bindung stattfindet, sondern auch über die treibenden Kräfte hinter der Interaktion. Bei jedem Therapeutikum ist es wichtig, vollständig zu klären, wie es mit dem Ziel interagiert. Dazu zählt auch die Spezifität, bzw. die Kenntnis dessen, wie spezifisch das Therapeutikum für das Ziel ist. Die Sicherstellung einer hohen Spezifität führt zu einem Therapeutikum mit weniger unerwünschten Nebenwirkungen aufgrund einer Bindung außerhalb des Ziels. Weitere wichtige Attribute, die in dieser Phase charakterisiert werden müssen, sind die Konformationsstabilität, die kolloidale Stabilität, die Wirkstärke und die Plasmastabilität. Diese Informationen werden in Kombination verwendet, um unerwünschte Antikörper auszusondern.3
Kandidatenauswahl
In der Phase der Kandidatenauswahl geht es um die Beurteilung der Antikörper, die für den therapeutischen Einsatz am vielversprechendsten sind. Die in dieser Phase verwendeten Techniken erfordern höhere Konzentrationen (bis zu 100 mg/ml), und es werden ähnliche Arten von Informationen erfasst, wie z. B. Konformations-stabilität und kolloidale Stabilität. In dieser Phase sind jedoch Daten mit höherer Auflösung erforderlich. Die Konformationsstabilität wird durch Charakterisierung sowohl der Tonset als auch der TM mittels dynamischer Differenzkalorimetrie (Differential Scanning Calorimetry, DSC) geprüft.
Mit automatisierter Nano DSC lässt sich die kurzzeitige thermische Stabilität der Proben ohne den Einsatz von exogenen Markern oder Farbstoffen charakterisieren, wodurch Arbeitsabläufe vereinfacht und Fehler bei der biopharmazeutischen Entwicklung reduziert werden.2 In ein und demselben Experiment können die Schmelztemperatur, die Enthalpie und die Änderung der Wärmekapazität bestimmt werden, was es ermöglicht, die freie Energie zu berechnen, um eine fundierte Entscheidung darüber zu treffen, welche Formulierung am stabilsten ist.2 Diese effiziente Bestimmung erleichtert den Prozess der Kandidatenauswahl. Darüber hinaus finden auch eine physikalisch-chemische Charakterisierung, eine Analyse der PK/PD in vivo und die Beurteilung von Hilfsstoffen statt.
Formulierung
Nachdem ein oder zwei Antikörper ausgewählt wurden, geht es um die Optimierung der endgültigen Formulierung für erste Versuche am Menschen. Wiederum ist die Konformationsstabilität ein entscheidendes Merkmal, das es in diesem Formulierungsprozess zu messen und zu überwachen gilt. Durch Variation von pH-Wert, Salz, Zuckern und Tensiden werden verschiedene Formulierungen hergestellt. Jede Kombination verändert wahrscheinlich die Konformationsstabilität, daher ist es wichtig, die Stabilität zu messen. Anders als bei einigen anderen Phasen ist es in dieser Phase wichtig, Tests zur endgültigen Antikörperdosierung durchzuführen (bis zu 200+ mg/ml). Die wertvollste Technik für Stabilitätstests ist die dynamischer Differenzkalorimetrie, die genaue Stabilitätsmessungen ermöglicht, um verschiedene Formulierungen zu vergleichen und herauszufinden, welche das größte Potenzial für die Weiterentwicklung aufweist.2
Abgabe
Ein weiterer wichtiger Bereich, der während des Formulierungsprozesses und/oder des Prozesses der Formulierung des Produkts für den Handel berücksichtigt werden muss, ist die Art der Abgabe. Die Art der Abgabe beeinflusst die endgültige Dosierung und die endgültige Form des Produkts, ob flüssig oder lyophilisiert. Die beiden gängigsten Abgabemethoden für Antikörper-Arzneimittelformulierungen sind die stabile subkutane Injektion einer Flüssigkeit oder die intravenöse Infusion lyophilisierter und rekonstituierter Lösungen.4 Wenn die Formulierung zur Verbesserung der Haltbarkeit lyophilisiert wird, ist die Bestimmung der Glasübergangstemperatur oder Kollapstemperatur wichtig für das Verständnis der Bedingungen für die Lyophilisierung.5 Während des primären Trocknungsschritts ist es wichtig, einen Temperaturanstieg zu verwenden, der unter dieser Temperatur bleibt, um ein Kollabieren oder Schrumpfen der Struktur zu verhindern. Die dynamische Differenzkalorimetrie ist der Gold-Standard und die bevorzugte Technik, um diese Informationen zu erlangen.
Modernste Mikrokalorimeter für eine schnellere Arzneimittelentwicklung
Der Prozess zur Entwicklung von Arzneimitteln ist langwierig und mühsam. Daher bietet TA Instruments effiziente, benutzerfreundliche Lösungen, um Forschung, Entwicklung und Herstellung zu erleichtern. In enger Zusammenarbeit mit den einzelnen Kunden ermittelt TA für jeden Meilenstein der Arzneimittelentwicklung die ideale Lösung für den gewünschten Zweck. Unser Angebot an Mikrokalorimetrie-Geräten ist speziell darauf ausgelegt, mit den individuellen Forschungsanforderungen zu wachsen, und kann jederzeit durch eine automatische Probenahmevorrichtung ergänzt werden. Die langjährige Erfahrung von TA Instruments mit hochempfindlichen Geräten gewährleistet glaubwürdige, zuverlässige Daten.
Literaturhinweise
- In silico pharmacology for drug discovery: Methods for virtual ligand screening and profiling—PMC. (n.d.). Retrieved October 20, 2023, from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1978274/
- Nano DSC – TA Instruments. (2023, March 19). https://www.tainstruments.com/nanodsc/
- Affinity ITC – TA Instruments. (n.d.). Retrieved October 20, 2023, from https://www.tainstruments.com/affinity-itc-auto/
- Belissa, E., Vallet, T., Laribe-Caget, S., Chevallier, A., Chedhomme, F.-X., Abdallah, F., Bachalat, N., Belbachir, S.-A., Boulaich, I., Bloch, V., Delahaye, A., Depoisson, M., Wojcicki, A. D., Gibaud, S., Grancher, A.-S., Guinot, C., Lachuer, C., Lechowski, L., Leglise, P., … Boudy, V. (2019). Acceptability of oral liquid pharmaceutical products in older adults: Palatability and swallowability issues. BMC Geriatrics, 19(1), 344. https://doi.org/10.1186/s12877-019-1337-2
- Affairs, O. of R. (2022). Lyophilization of Parenteral (7/93). FDA. https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-guides/lyophilization-parenteral-793
Sonstige Ressourcen
- Anwendungshinweis – Characterizing Virus Structure and Binding
- Anwendungshinweis – Characterizing Protein – Protein Interactions by ITC
- Anwendungshinweis – Characterization of Biopharmaceutical Stability
- Anwendungshinweis – Advances in Native Binding Assays
- Anwendungshinweis – Determining Thermal Stability of Antibodies with a Nano DSC
- Anwendungshinweis – A Novel Thermodynamic Assay for Predicting and Monitoring Biomolecular Structure Stability
- Webinar – Biophysical Characterization of Antibodies in a Suspension: Solutions for Slurries
- Webinar – Biophysical Characterization of Antibody Drug Conjugates Using DSC
- Gerät – Nano DSC
- Gerät – Isothermal Titration Calorimeters (ITC)
- Gerät – Isothermal Microcalorimeters
- Kontakt – TA Instruments kontaktieren