Schlüsselwörter: Mikrokalorimetrie, elektrochemisch, Wärme, Batterie, Akku, Lithium-Ionen-Akku, Primärbatterie, Sekundärbatterie, Selbstentladung, parasitäre Reaktion
MC158-DE
HINTERGRUND
Elektrische Energie treibt die Welt an, und wir verlassen uns darauf, dass sie jederzeit in Wärme, Licht, chemische Bindungen oder mechanische Arbeit verwandelt werden kann. Aber für immer mehr Anwendungen wie Smartphones, Elektrofahrzeuge und unterschiedlichste Haushaltsgeräte benötigen wir heute eine „mobile“ Stromversorgung. Viele dieser Geräte erfordern große Mengen an Energie, die auf kleinstem Raum gespeichert werden müssen. Dies treibt weitreichende Innovationen in der Entwicklung neuer Batterietechnologien an, um die Anzahl der Ladezyklen von Akkuzellen zu erhöhen, die Nutzungsdauer zu verlängern und die Sicherheit zu verbessern. Ohne Übertreibung kann gesagt werden, dass es der Lithium-Ionen-Akkumulator ist, der in seinen unterschiedlichen chemischen Zusammensetzungen und Bauarten die Entwicklung batteriebetriebener Fahrzeuge und zahlreicher tragbarer Geräte möglich macht. So wurden die Erfinder der Lithium-Ionen-Zelle für ihren Beitrag zu einer „wiederaufladbaren Welt“ 2019 mit dem Nobel-Preis in Chemie gewürdigt, und der Markt für wiederaufladbare Batterien wird weiterhin von Lithium-Ionen-Akkumulatorzellen dominiert. Doch mittlerweile konzentrieren sich die Forschungs- und Entwicklungsanstrengungen auch auf andere chemische Zusammensetzungen.
Die in einer Batterie stattfindenden elektrochemischen Prozesse erhöhen den Wärmeaustausch mit der Umgebung, unabhängig davon, ob dies unter Belastungs- oder Ladebedingungen geschieht. Die verrichtete Arbeit, wenn geladene Teilchen im Inneren einer Zelle fließen, führt ebenso zu Wärmeentwicklung wie die Redox-Prozesse an Anode und Kathode und verschiedene parasitische Nebenreaktionen, die die Lebensdauer einer Batterie begrenzen.
Die Prozesse, die materielle Veränderungen bewirken, werden in der Regel von einem Wärmeaustausch mit der Umgebung begleitet. Je schneller die Geschwindigkeit der chemischen oder physischen Veränderung ist, desto höher ist die Wärmeproduktionsrate. Der heutige Stand der Technik für die Bestimmung eines breiten Spektrums an physikalischen, chemischen oder biologischen Phänomenen ist die isotherme Kalorimetrie. Ein isothermes Mikrokalorimeter überwacht die Wärmeentwicklung in Echtzeit, während der Prüfling auf konstanter Temperatur gehalten wird.
In den vergangenen Jahrzehnten wurde die isotherme Kalorimetrie vorwiegend eingesetzt, um die Selbstentladung von Primärbatterien zu untersuchen, zum Beispiel von Batterien, die in Herzschrittmachern verwendet werden (Hansen und Hart, 1978). Aber seit einigen Jahren ist ein starker Anstieg des Interesses an der isothermen Mikrokalorimetrie in der Batterieforschung und -entwicklung zu bemerken, sowohl im akademischen als auch im industriellen Bereich. Diese gesteigerte Aktivität konzentriert sich hauptsächlich auf Sekundärbatterien, insbesondere auf Lithium-Ionen-Akkumulatoren.
Dabei kommt in der Regel ein Typ von Mikrokalorimeter zum Einsatz, der die Wärmeleitung oder den Wärmestrom misst. Der Batterieprüfling wird bei diesem Gerät in einem abnehmbaren Probenbehälter platziert (siehe Suurkuusk et al 2017 für eine ausführliche Beschreibung eines modernen Mikrokalorimetriesystems). Mikrokalorimeter werden unter präzisen kontrollierten Umgebungsbedingungen betrieben, um die Temperatur in Grenzbereichen von wenigen Mikrokelvin stabil zu halten. Wenn die Batterie Wärme abgibt oder aufnimmt, wird der Wärmefluss zwischen der Batterie und der temperaturkontrollierten Umgebung gemessen, während der Batterieprüfling auf einer konstanten Temperatur gehalten wird. Der Wärmefluss wird von thermoelektrischen Sensoren gemessen, die sich zwischen dem Prüfling und der Kontrollumgebung befinden.
Dieser Artikel soll einen Überblick über die isotherme Mikrokalorimetrie in der Batterieforschung, -entwicklung, und -qualitätskontrolle bieten, um die Vielseitigkeit dieser Technik und ihre Einsatzmöglichkeiten in diesem Bereich aufzuzeigen.
WÄRMEENTWICKLUNG IN BATTERIEPROZESSEN
Beim Laden oder Entladen einer Batterie entsteht Wärme aufgrund von verschiedenen Prozessen, die Wärme produzieren oder verbrauchen. Dahn et al (1985) untersuchten mithilfe von isothermer Kalorimetrie die Interkalation von Lithium in LixMo6Se8 in elektrochemischen Zellen. Sie entwickelten ein Modell zur Berechnung der einzelnen Beiträge zur Gesamtwärmeproduktion einer Lithium-Ionen-Akkumulatorzelle, das mit der folgenden einfachen Formel beschrieben werden kann:
PTotal = PPolarization + PEntropic + PParasitic (1)
Die Studie zielte darauf ab, den umkehrbaren entropischen Ausdruck der Gleichung genauer zu bestimmen, um die Entropieänderung der Einlagerungsverbindung in Abhängigkeit von der Lithiumbeladung x zu schätzen. Zu diesem Zweck versuchten sie, die theoretischen Gas-Gittermodelle für die Interkalation experimentell zu validieren.
Der Polarisierungsausdruck, der exotherm ist, enthält jeden Prozess, der bewirkt, dass die Spannung der Zelle von der thermodynamischen Spannung abweicht. Ein Beispiel für einen solchen Prozess ist der Fluss geladener Spezies wie Elektronen oder Ionen innerhalb der Zelle. Der umkehrbare Ausdruck entspricht der Entropieänderung der Zelle während des Ladens oder Entladens, zum Beispiel der Veränderung des thermodynamischen Zustands eines Elektrodenmaterials relativ zur Anzahl der eingelagerten Lithium-Ionen. Bei parasitären Reaktionen handelt es sich in der Regel um irreversible Änderungen der Zellchemie, die die Nutzungsdauer der Batterie einschränken. Die Menge der bei solchen Reaktionen produzierten Wärme ist ein genaues Maß für den Beitrag, den diese Reaktionen zur Verkürzung der Batterielebenszeit leisten.
Aus diesem Modell wurde später eine Methode zur Quantifizierung parasitärer Reaktionen in Lithium-Ionen-Zellen entwickelt, bei der die isotherme Mikrokalorimetrie zum Einsatz kommt (Krause et al 2012).
SELBSTENTLADUNG
Batterien unter offenen Stromkreisbedingungen generieren in der Regel schwache Wärmeströme, die auf Selbstentladungsprozesse zurückzuführen sind. Selbstentladung kann als Verlust von Energie definiert werden, durch den sich die Nutzungsdauer einer Batterie verkürzt. Dies gilt nicht nur für Primärbatterien, sondern auch für Sekundärbatterien, bei denen die Selbstentladung zum Teil reversibel ist, indem die Zelle wiederaufgeladen wird, und zum Teil irreversibel ist. Für viele Zelltypen sind die Mechanismen der Selbstentladungsprozesse noch nicht ausreichend bekannt. Doch es kann vernünftigerweise davon ausgegangen werden, dass die Haltbarkeit bzw. die Anzahl der Ladezyklen eines Batterietyps umso geringer ist, je höher seine Wärmeproduktionsrate ist.
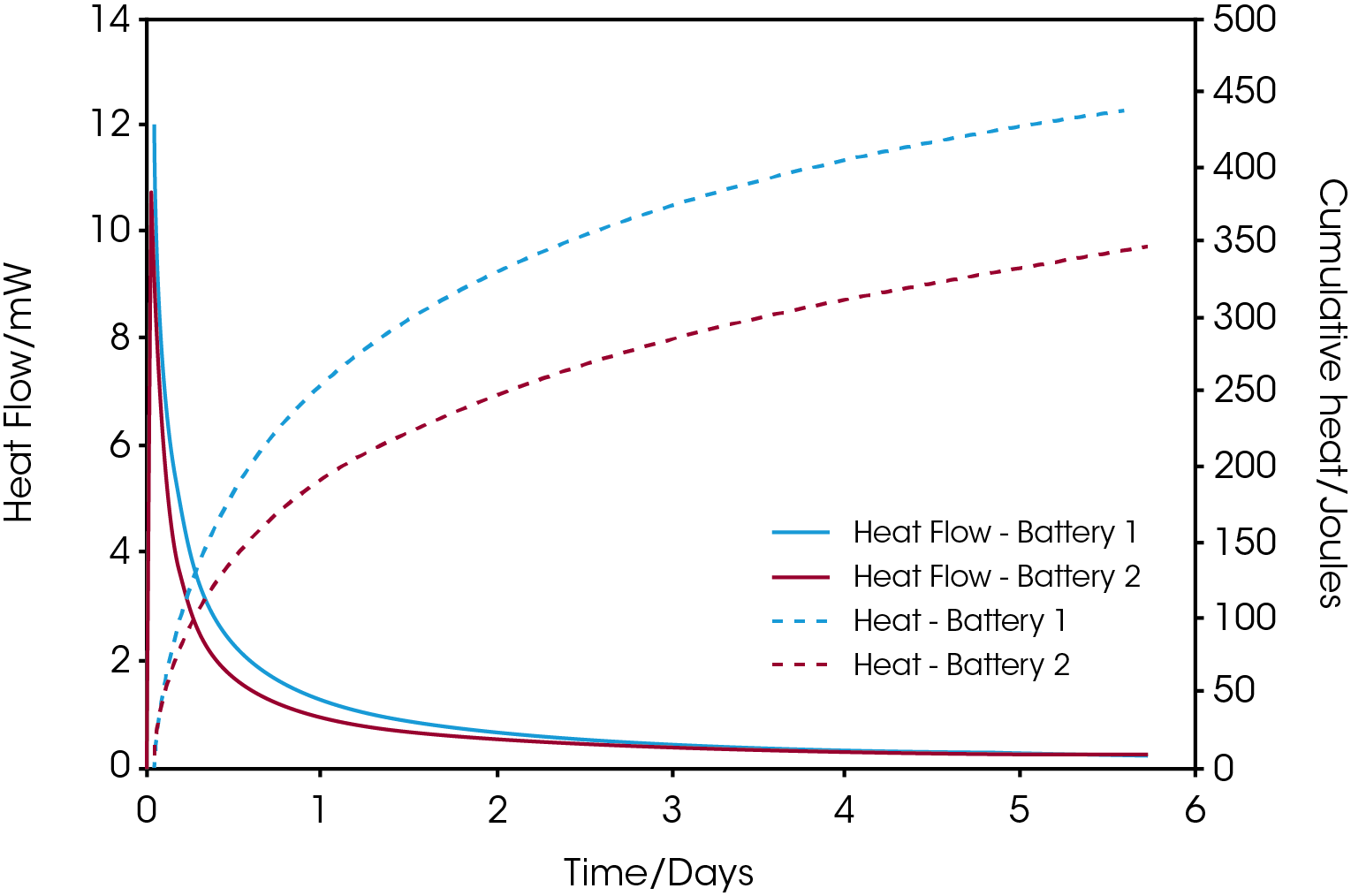
Abbildung 1 zeigt den Wärmestrom bei der Selbstentladung und die kumulativen Wärmekurven für handelsübliche AAA-NiMH-Batterien zweier Hersteller. Die Batterien wurden zu 100 % aufgeladen, bevor sie bei 25 °C in das Kalorimeter gegeben wurden. Wir sehen, dass Batterie 1 in den ersten drei Tagen eine höhere Entladungsrate zeigt, aber dass der Wärmestrom beider Batterien sich danach auf etwa dasselbe Niveau einpegelt. Die kumulativen Wärmekurven lassen erkennen, dass der Unterschied bei der Wärme, die die beiden Batterien abgeben, nach 5,7 Tagen bei knapp 100 Joule liegt.
Roth (1999) untersuchte die Selbstentladung von Lithium-Ionen-Zellen in Abhängigkeit von der Temperatur und dem Ladezustand (State of Charge, SOC) an zwei verschiedenen Metalloxid-Einlagerungsverbindungen. Bei einem Ladezustand im Bereich 0 %–100 % und in einem Temperaturintervall von 40 °C–70 °C wurden bei den Selbstentladungsprozessen starke Abhängigkeiten beobachtet. Die mikrokalorimetrischen Messungen zeigten eine stärkere Reaktivität bei Zellen mit Kathoden der Zusammensetzung LixNi0,8Co0,2O2 als mit LixCoO2-Kathoden. Außerdem wurde eine Korrelation zwischen der Tendenz zum thermischen Durchgehen („Runaway“) und dem gemessenen Wärmestrom im untersuchten Temperaturintervall gefunden.
Hansen and Hart (1978) charakterisierten die internen Energieverluste von Schrittmacherbatterien. Das Ziel ihrer Studie bestand in der Entwicklung einer schnellen und zuverlässigen Qualitätssicherungsmethode, um Batterien mit abnorm hohen Selbstentladungsraten auszumustern. Bei den Tests mit MgO/Zn- und Lithium-Iod-Batterien gelang es ihnen, Prüflinge mit hohen und niedrigen Selbstentladungsraten erfolgreich zu unterscheiden. Außerdem beobachteten sie, dass das Alter einer Batterie einen Einfluss auf den Wärmestrom bei der Selbstentladung hatte, was bei der Interpretation der kalorimetrischen Daten berücksichtigt werden muss.
Heutzutage können Schrittmacherbatterien in isothermen Mikrokalorimetern Qualitätsprüfungen unterzogen werden. Diese Tests werden häufig an dem Medizingerät, das heißt, am Schrittmacher selbst, durchgeführt. Der Wärmefluss von einem passiven Gerät muss äußerst gering sein und unter 20 μW liegen. Im Allgemeinen sind nicht mehr als 10 μW zulässig.
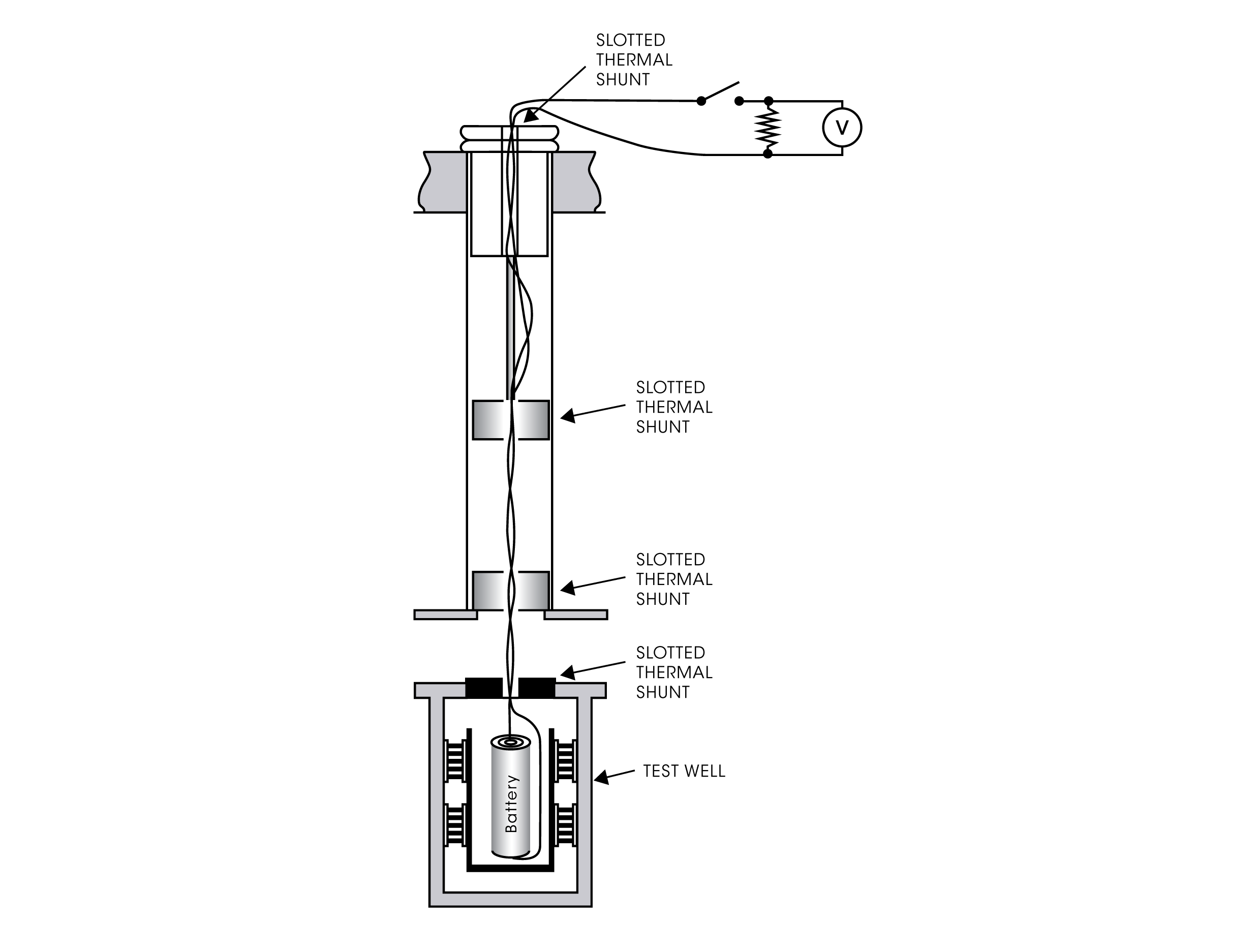
MESSUNGEN IM GESCHLOSSENEN STROMKREIS
Bei einem modernen Mikrokalorimetriesystem wie dem TAM IV oder TAM XL können mehrere Experimentalaufbauten eingerichtet werden, um Batterieprozesse unter geschlossenen Stromkreisbedingungen zu messen. Die Batterien oder andere elektronische Prüflinge werden in speziell konzipierten Ampulleneinsätzen platziert, an die elektrische Leitungen angeschlossen werden können. Die Leitungen werden vom Kalorimeter zu einer extern platzierten Elektronikkomponente geführt, beispielsweise zu einem Widerstand und/oder zu einem anderen Elektrogerät wie einer Stromquelle, einem Spannungsmessgerät usw. Auf diese Weise kann die in der Batterie während der Lade-/Entladezyklen produzierte Wärme gemessen werden.
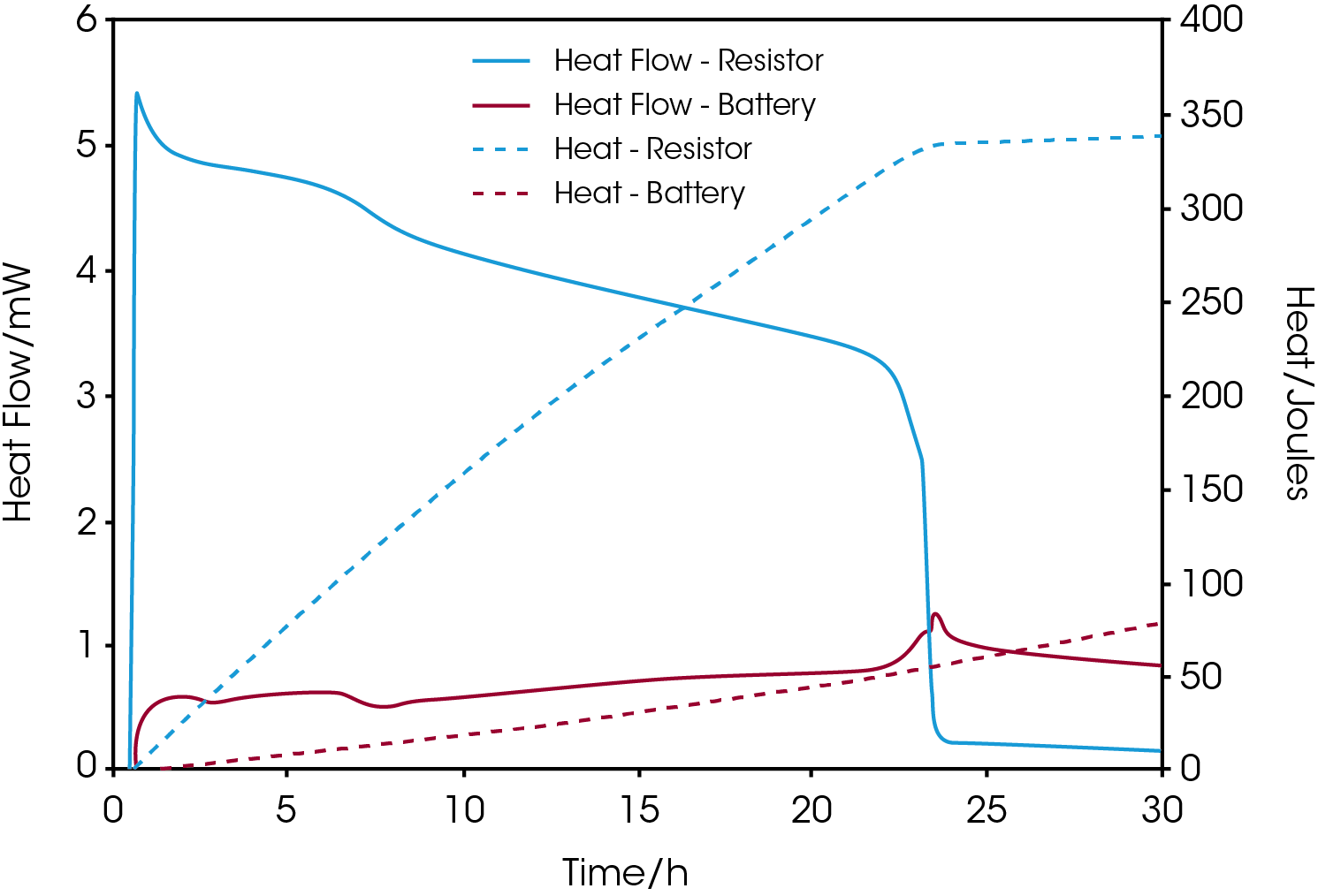
Auf einer Kalorimetrie-Plattform mit mehreren Kanälen wie dem TAM IV können unabhängig voneinander zwei oder mehr Kalorimeter gleichzeitig verwendet werden, um zusätzlich zum Wärmestrom der Batterie auch die Wärme von einer elektronischen Komponente, wie beispielsweise einem Widerstand, zu messen. Solche Messungen ermöglichen es, die Gesamtenergiebilanz der Wärmeproduktion zu bestimmen. Abbildung 3 zeigt den Wärmestrom und die kumulative Wärme einer handelsüblichen Silberoxid-Zink-Knopfzelle. Bei der Messung wurde die Batterie an einen 380-Ohm-Widerstand angeschlossen, der sich in einem zweiten Kalorimeter befand.
Der Graph zeigt, dass mit abnehmendem Stromfluss durch den Widerstand aufgrund des Spannungsabfalls über den Zeitverlauf eine gleichzeitige Zunahme der Wärmeproduktion der Batterie beobachtet wird. Wenn sich der Wärmefluss des Widerstands nach etwa 23 Stunden Messzeit null annähert, beträgt die Gesamtmenge der freigesetzten Wärme ca. 330 Joule. Dies entspricht einem Restenergiegehalt von 75 mAh.
Der Begriff „elektrochemische Kalorimetrie“ beschreibt die Kombination eines isothermen Mikrokalorimetrieverfahrens mit einem hochauflösenden Spannungsmessgerät und einer Präzisionsstromquelle, um Lade-/Entladezyklen unter unterschiedlichen Ladebedingungen zu untersuchen (Krause et al, 2012). Solche Experimente ermöglichen es nicht nur, die kalorimetrischen Daten zu den Coulomb-Wirkungsgraden in Beziehung zu setzen, sondern auch, die einzelnen Beiträge zum Gesamtwärmestrom gemäß Formel 1 zu differenzieren und zu quantifizieren.
PARASITÄRE REAKTIONEN
Krause et al (2012) beschrieben eine Methode zur Differenzierung der einzelnen parasitären Wärmeereignisse in der Gesamtwärmeproduktion und damit zur Quantifizierung der parasitären Reaktionen. Zu diesem Zweck führten sie Messungen gesamter Lade-/Entladezyklen durch. Der Beitrag der Polarisierung wurde anhand der integrierten Spannungshysterese bestimmt und konnte dann vom Wärmestrom, der über einen vollständigen Lade-/Entladezyklus gemessen wurde, subtrahiert werden. Die Forscher kamen zu dem Schluss, dass sich die reversiblen Wärmeflüsse aufheben, wenn sie über einen vollständigen Zyklus gegeneinander aufgerechnet werden. Daraus folgt, dass die verbleibende Wärme nach der Subtraktion des Beitrags der Polarisierungseffekte das Resultat parasitärer irreversibler Reaktionen ist. Sie stellten fest, dass zwischen der parasitären Wärme und der Menge des verlorenen aktiven Lithiums eine lineare Korrelation bestand. Dies machte es möglich, die Enthalpieänderung für die parasitären Reaktionen zu bestimmen. In diesem Fall betrug sie schätzungsweise -212 kJ/mol-1. Die Ergebnisse zeigten, dass die parasitäre Energie bei einer Graphitelektrode mit größerer Oberfläche höher war als bei einer mit kleinerer Oberfläche.
Downie et al 2013 kombinierten ein TAM-Mikrokalorimeter mit einem Batteriecycler für ihre qualitative Studie, in der sie über einen festgelegten Spannungsbereich untersuchten, wie sich ein Elektrolytzusatz auf die Stabilität von LiCoO2/Graphit-Pouch-Zellen auswirkte. Sie nahmen Messungen von Lade-/Entladezyklen mit geringem Ladestrom vor, wobei sie den Zellen verschiedene Mengen von Vinylencarbonat zusetzten, sie aber anderweitig nicht veränderten. Sie verglichen den Wärmestrom aus den Zellen, die den Zusatzstoff enthielten, mit dem Wärmestrom aus Kontrollzellen ohne Additiv. Jegliche Unterschiede konnten dann dem Effekt des Zusatzes zugeschrieben werden. Dabei beobachteten sie deutliche Veränderungen des Wärmeflusses: Je höher die Konzentration des Zusatzstoffs war, desto geringer war der Wärmestrom, was auf höhere Stabilität hindeutete. Eine weitere Erkenntnis war, dass das Additiv ab einer bestimmten Konzentration (2 %) die Stabilität nur noch geringfügig weiter verbesserte. Dies macht es möglich, die optimale Konzentration von Vinylencarbonat im Elektrolyten zu bestimmen.
STRUKTURENTWICKLUNG
Während des Ladevorgangs fließen Lithium-Ionen von der positiven zur negativen Elektrode, wo sie sich einlagern. Dadurch verändert sich die Kristallstruktur, was Auswirkungen auf die Entropie der Konfiguration hat und sich am Wärmestromsignal – dem zweiten Ausdruck von Gleichung 1 – erkennen lässt. Wenn es sich dabei um einen reversiblen Prozess handelte, würden sich die Signale des Lade- und Entladevorgangs gegeneinander aufheben. Aufgrund der Entropie der Konfiguration ergibt sich jedoch manchmal ein stärker ausgeprägtes Wärmeflusssignal. Dieses Ereignis, das mit der Lithiumbeschichtung korreliert, kann mit elektrochemischen Methoden schwierig nachgewiesen werden. Downie, at al (2013).
Mithilfe isothermer Wärmeflussdaten kann außerdem unerwartetes Materialverhalten wie Kristallisierung erkannt werden. Kristallisierungsereignisse bewirken einen sehr steilen exothermen Peak, der mit elektrochemischen Methoden kaum erkennbar ist (Chevrier et al, 2021).
SICHERHEITSBEWERTUNGEN
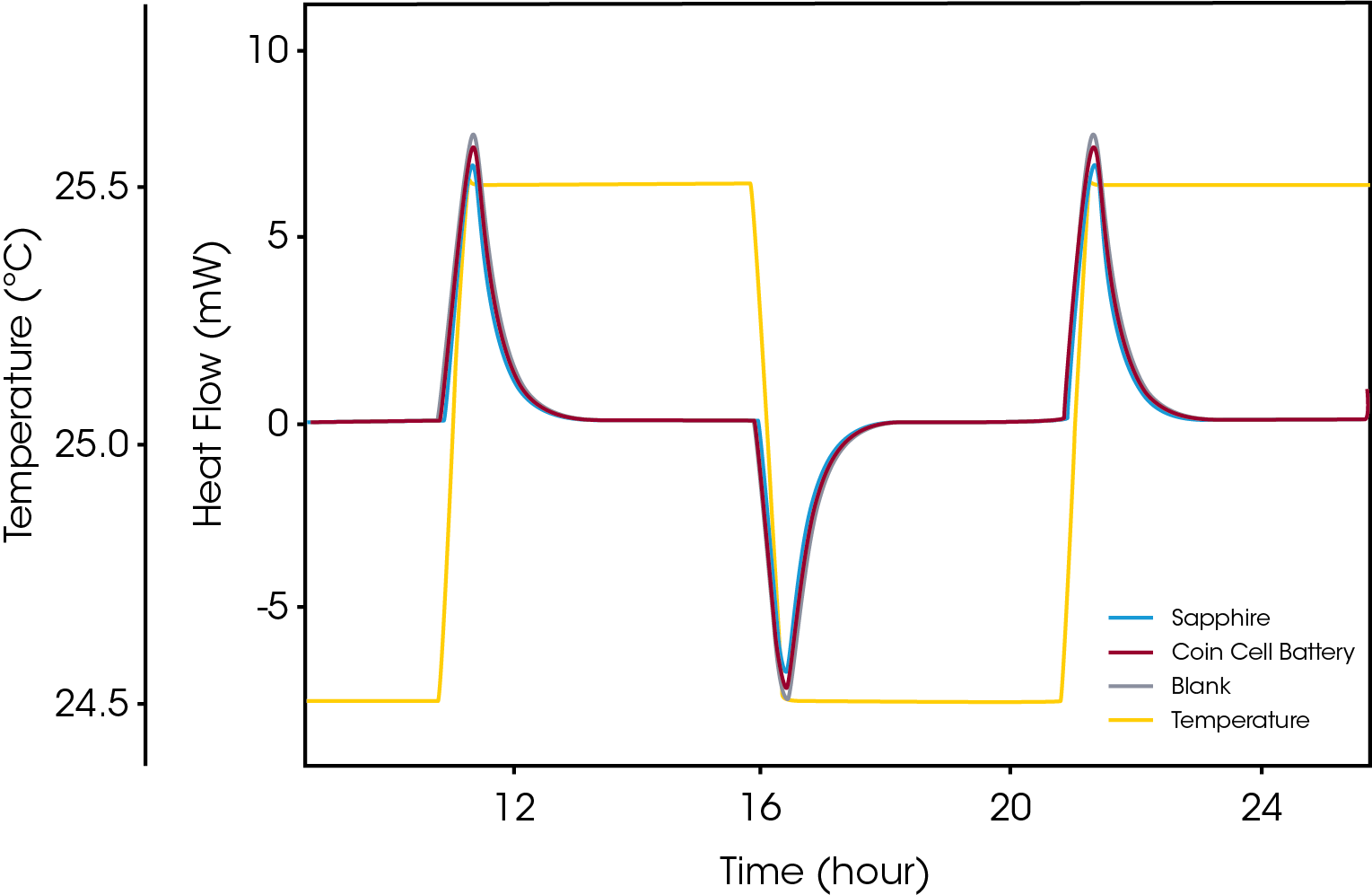
Die Speicherung chemischer Energie hoher Dichte ist in der Regel mit Sicherheitsgefahren verbunden, da das Risiko exothermer Dekomposition mit unkontrollierten Kettenreaktionen besteht, was zu Bränden oder Explosionen führen kann. Bei der Lagerung von Batterien gelten dieselben Sicherheitsbedenken wie für hochenergetische Materialien wie Sprengstoffe. Bei Lithium-Ionen-Zellen wird zum Beispiel versucht, den Energiegehalt zu erhöhen, da das Lithium in seiner reduzierten Form äußerst reaktiv ist. Die Wärmeproduktionsrate im Material ist naturgemäß ein kritischer Parameter bei der Beurteilung von Situationen, in denen ein Risiko von thermischem Durchgehen besteht. Ein bewährtes Verfahren für solche Beurteilungen ist die Mikrokalorimetrie, mit der verschiedene hochenergetische Materialien geprüft werden können. Neben der Wärmeproduktionsrate müssen auch die thermischen Eigenschaften der ganzen Batterie zuverlässig bestimmt werden, um einschätzen zu können, wie hoch die Temperatur während den verschiedenen Ladezuständen beim Laden oder Wiederaufladen ansteigt. Eine dieser Eigenschaften ist die Wärmekapazität der Batterie, die mikrokalorimetrisch präzise gemessen werden kann. Abbildung 4 zeigt das Ergebnis einer typischen „stufenweisen isothermen“ Messung einer ganzen Batterie.
FAZIT
Dank neuer, äußerst flexibler Mikrokalorimetrie-Instrumente, deren Nachweisgrenzen sich dem Nanowatt-Bereich annähern, sehen wir ein gesteigertes Interesse für kalorimetrische Messungen in der Batterieforschung, -entwicklung und -qualitätskontrolle. Die breite Auswahl an Probeeinsätzen macht es möglich, problemlos Messungen an Batterien unterschiedlicher Bauarten – wie Knopfzellen, Zylinder der Größen AA, AAA und 18650 sowie Pouch-Zellen – sowohl unter offenen als auch geschlossenen Stromkreisbedingungen durchzuführen.
Die empfindlichsten TAM-IV-Kalorimeter haben eine Nachweisgrenze, die es erlaubt, sogar die schwachen Selbstentladungsraten der kleinsten Knopfzellen oder den Wärmestrom von Lade-/
Entladezyklen im untersten Spannungsbereich zu messen.
In Kombination mit einer Stromquelle und einem Spannungsmessgerät oder einem kommerziellen Batteriecycler machen es diese Instrumente einfach, parasitäre Reaktionen in Abhängigkeit von Spannung, Temperatur und der jeweiligen Batteriechemie quantitativ zu bestimmen.
Das flexible TAM-System unterstützt eine Vielzahl von Versuchsaufbauten, sodass der Kreativität der Forschenden bei den Experimenten keine Grenzen gesetzt sind.
LITERATURHINWEISE
1. Chevrier et al (2021) Isothermal Calorimetry Evaluation of Metallurgical Silicon as a Negative Electrode Material for Li-Ion Batteries, J. Electrochem. Soc. 168
2. Downie (2013) The Impact of Electrolyte Additives Determined Using Isothermal Microcalorimetry, ECS Electrochemistry Letters, 2 (10)
3. Downie (2013) In Situ Detection of Lithium Plating on Graphite Electrodes by Electrochemical Calorimetry, Journal of The Electrochemical Society, 160 (4)
4. Hansen, L.D., and Hart (1978) The characterization of internal power losses in pacemaker batteries by calorimetry, J. Electrochem. Soc.: Electrochemical science and technology 125(6).
5. Krause, L. J., Jensen, L. D., and Dahn, J. R. (2012) Measurement of parasitic reactions in Li-ion cells by electrochemical calorimetry, J. Electrochem. Soc 159 (7).
6. Roth, E. P. (1999) Thermal Stability of Li-Ion Cells, United States. https://www.osti.gov/servlets/purl/14010.
7. Suurkuusk, J., Suurkuusk, M., and Vikegard, P. (2017) A multichannel microcalorimetric system: The third generation thermal activity monitor (TAM III), J. Therm. Anal. Calorim. 131.
DANKSAGUNG
Dieser Artikel wurde von Peter Vikegard, Ph.D, Applications Support bei TA Instruments, verfasst.
Wenn Sie weitere Informationen oder ein Preisangebot wünschen, besuchen Sie http://www.tainstruments.com/?lang=de. Auf der Website finden Sie Angaben zu Ihrer zuständigen Vertriebsniederlassung.
Hier klicken, um eine Druckversion dieses Anwendungsartikels herunterzuladen.

