Palabras clave: DSC, calorimetría diferencial de barrido, baterías de iones de litio, fuga térmica, cátodo, ánodo
TA467-ES
Resumen
La fuga térmica en las baterías de iones de litio es un problema de seguridad crítico. Puede ocurrir cuando los materiales de electrodo experimentan reacciones exotérmicas que causan temperaturas cada vez más altas y una cinética de reacción acelerada. Se sabe que el estado de carga de una batería puede afectar la temperatura de inicio, el mecanismo y la liberación de energía de las reacciones. La calorimetría diferencial de barrido se puede utilizar para evaluar la estabilidad térmica de los materiales del cátodo y el ánodo en diversos estados de carga. La temperatura de inicio de las reacciones, así como la temperatura de reacción máxima y la energía liberada, se pueden determinar al escanear materiales entre un rango de temperaturas al usar calorimetría diferencial de barrido (differential scanning calorimetry, DSC). En esta nota se evalúan un cátodo de litio, níquel, manganeso y cobalto (NMC) y un ánodo de grafito; se encuentra una energía de reacción más alta en el cátodo, y la estabilidad térmica es cada vez más alta con un estado de carga decreciente.
Introducción
Las baterías de iones de litio (Lithium-ion batteries, LIB) se utilizan ampliamente en diversas aplicaciones debido a sus propiedades favorables, como la alta densidad de energía. Sin embargo, se requieren sistemas de manejo de baterías debido a problemas de seguridad con las LIB. Cuando una batería se sobrecarga, queda expuesta a altas temperaturas o tiene un cortocircuito, puede ocurrir una fuga térmica. Cuando se alcanza una temperatura crítica se producen reacciones exotérmicas que hacen que la temperatura siga aumentando, lo que solo acelera la cinética de la reacción. Durante la fuga térmica ocurre degradación catastrófica, lo que lleva a la generación de gases tóxicos e ignición de la batería.
Se ha establecido que el estado de carga (state-of-charge, SOC) de una LIB tiene repercusiones directas sobre la fuga térmica. Las diferencias del SOC cambian la configuración térmica de la celda de la batería; el riesgo térmico está disminuido en baterías con un SOC más bajo, ya que la reducción de la carga aminora la liberación potencial de energía [1] [2]. Los materiales que se utilizan en la batería también afectan la fuga térmica, y la comprensión de las temperaturas de inicio de la fuga térmica para varias formulaciones y SOC tiene importancia en el diseño del manejo térmico y la prevención de la fuga térmica.
La calorimetría diferencial de barrido se puede utilizar para medir el flujo de calor de los materiales del electrodo. El escaneo en un rango de temperaturas permite la detección de reacciones exotérmicas que pueden llevar a una fuga térmica. Las repercusiones del SOC de los materiales en la temperatura de inicio y la cantidad de energía liberada son susceptibles de medición, lo que hace que la calorimetría diferencial de barrido sea una herramienta útil en la evaluación de la seguridad de las baterías.
Experimental
La NEI Corporation proporcionó baterías con diferentes estados de carga, con un cátodo de NMC811 y ánodo de grafito. Antes de la prueba, se desmontó la batería y se lavó el electrodo con carbonato de dimetilo (dimethyl carbonate, DMC) para eliminar los electrolitos. Este paso asegura que en las mediciones solo se evalúen los materiales del cátodo y el ánodo sin captar la degradación de electrolito [3]. Después de secar el electrodo, los materiales activos del ánodo y el cátodo se eliminaron del colector de corriente para realizar pruebas. Para comparación con las muestras cargadas, también se prepararon muestras de ánodo y cátodo tal como se recibieron, al usar el mismo procedimiento de lavado y secado que en las muestras de SOC.
El flujo de calor de los materiales de los electrodos se midió con un Calorímetro Diferencial de Barrido (Differential Scanning Calorimeter, DSC) de TA Instruments. Se cargaron muestras de aproximadamente 5 mg en la nueva bandeja de alta temperatura y alta presión (P/N 900803.901) y se aumentó la temperatura a 5 °C/min hasta 450 °C. La temperatura de inicio, el calor de reacción (entalpía) y la temperatura máxima se analizaron con el software TRIOS.
Resultados y discusiones
En la Figura 1 se muestran las temperaturas de inicio para el cátodo de NMC y el ánodo de grafito cargados por completo. La primera temperatura de inicio, que es el primer cambio exotérmico observado en el inicio, a menudo se relaciona con la descomposición inicial de la capa de interfaz de electrolito sólido (solid electrolyte interphase, SEI), lo que puede conducir a reacciones exotérmicas indeseables. El ánodo tiene una temperatura de inicio más baja, de 82 °C, que es característica de los ánodos de grafito comunes. Los ánodos de grafito suelen mostrar una descomposición inicial de la SEI entre 80 y 120 °C [4].
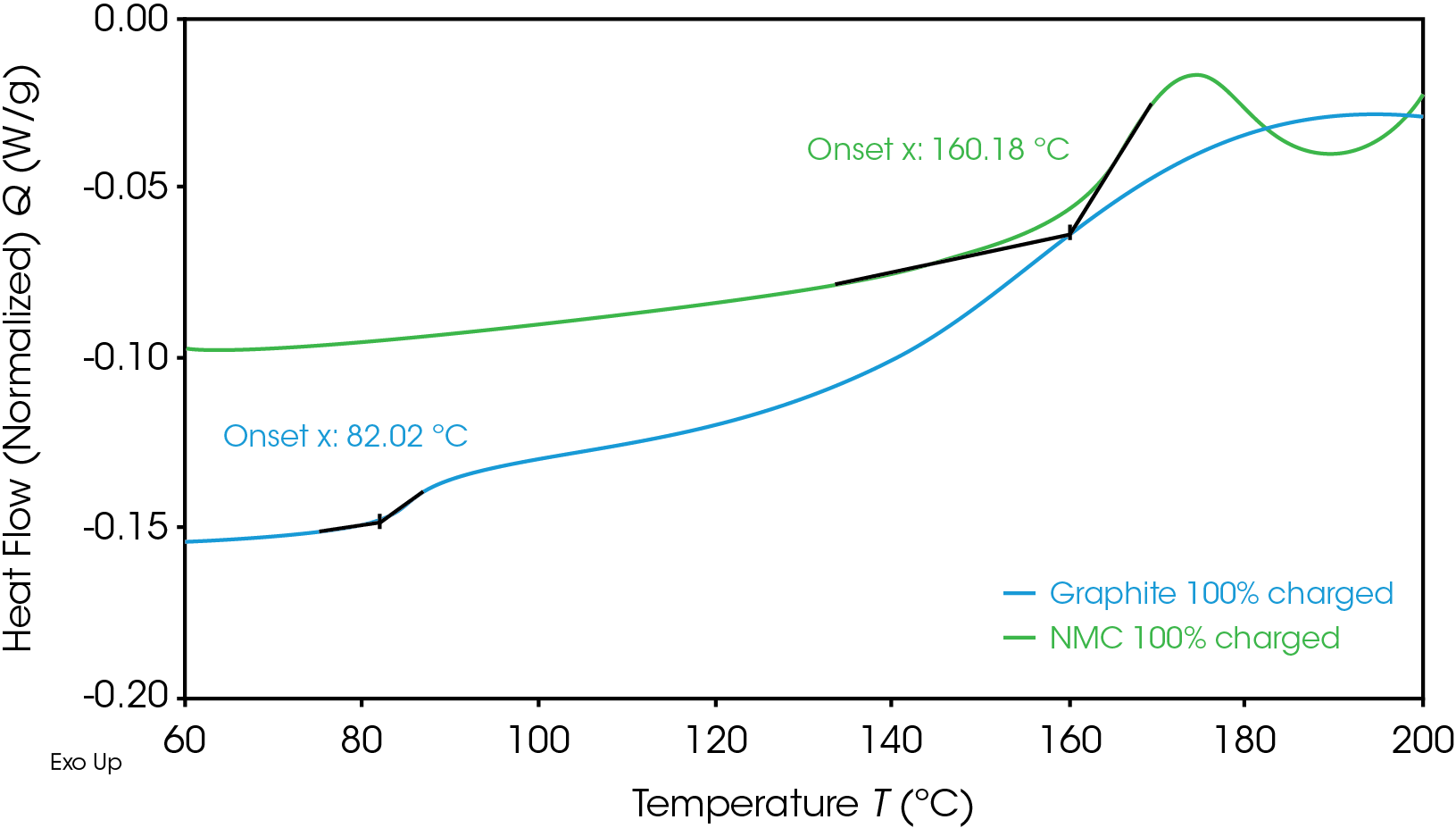
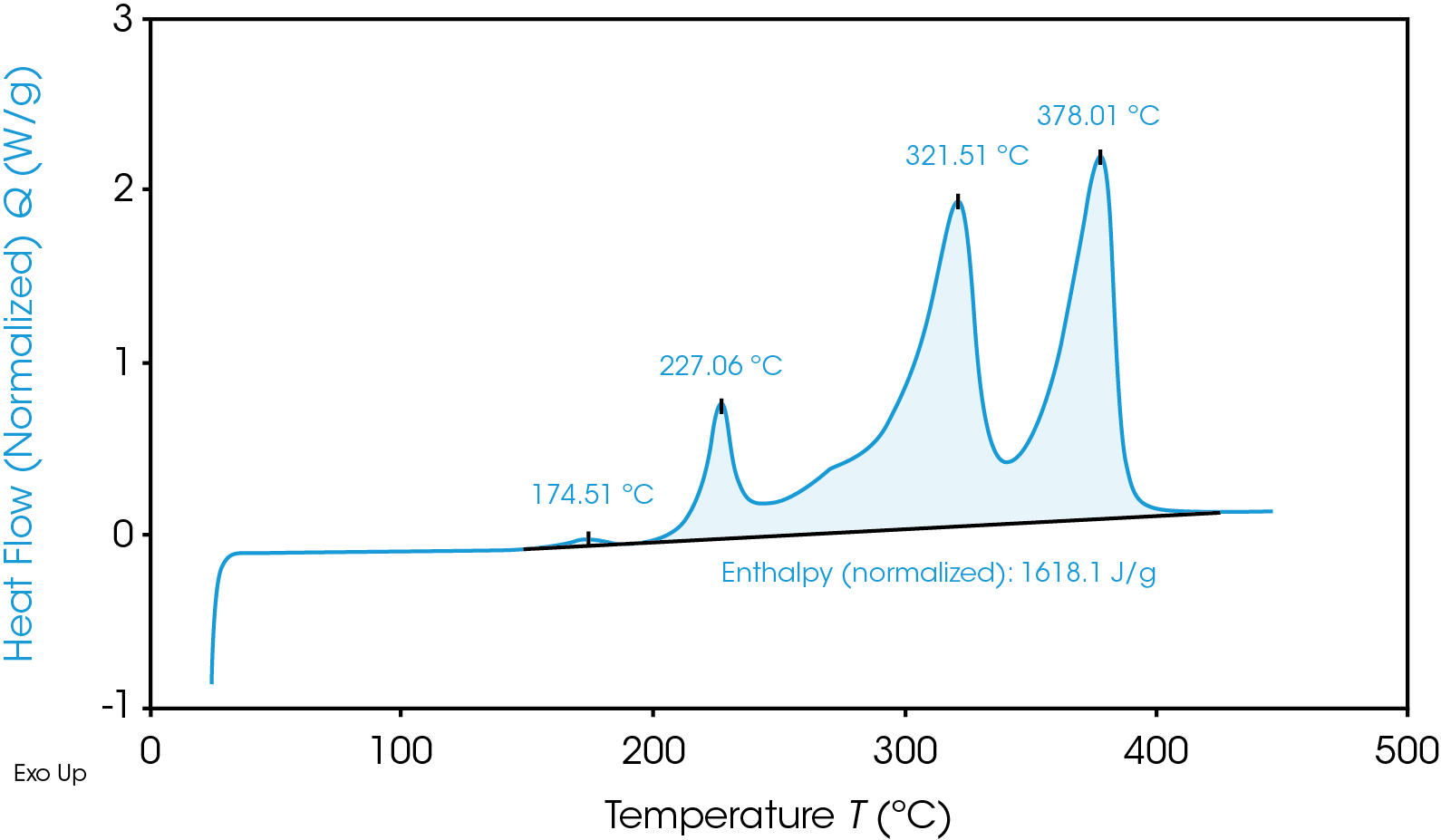
Pese a tener una temperatura de inicio más baja, el ánodo de grafito en general es menos energético que el cátodo de NMC, como se muestra en la Figura 2 por el área más pequeña debajo de la señal de flujo de calor de grafito. Esta área es la entalpía de reacción y se puede calcular al integrar la curva de señal de flujo de calor. El cátodo de NMC con SOC al 100% tiene una entalpía de 1618 J/g y la entalpía del ánodo de grafito con SOC al 100% es de 345 J/g. El cátodo de NMC con SOC al 100% experimenta reacciones exotérmicas más energéticas que el ánodo de grafito con SOC al 100%. Las reacciones exotérmicas, relacionadas con la degradación de los materiales del cátodo, ocurren a 227, 321 y 378 °C. Se sabe que por encima de
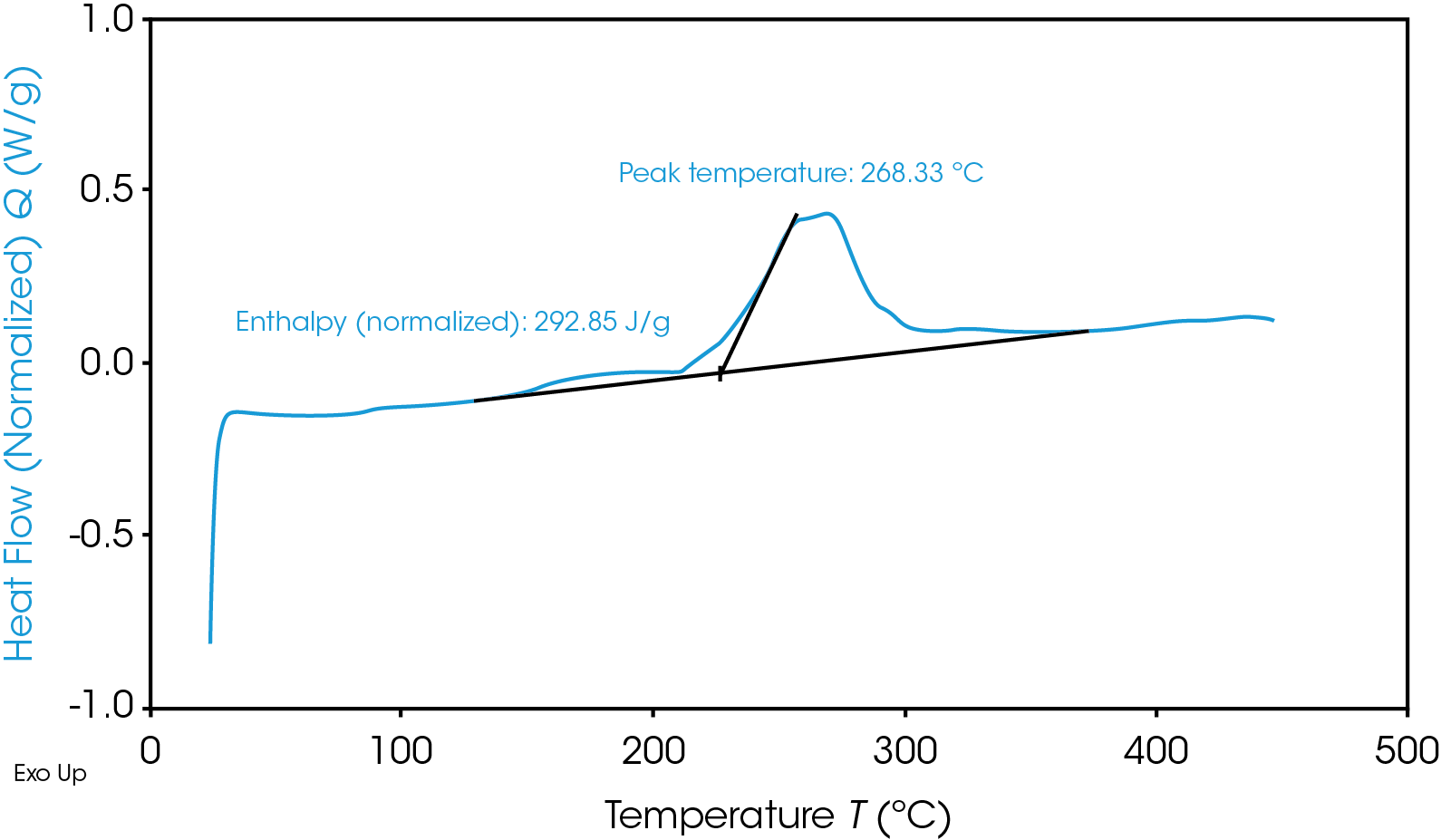
270 °C el NMC se vuelve térmicamente inestable y libera oxígeno [5]; los máximos a 321 y 378 °C quizá se relacionen con esta inestabilidad térmica. El ánodo de grafito cargado por completo tiene una reacción exotérmica mucho menor, a 268 °C. Es más probable que la mayor liberación de energía de las reacciones catódicas cause una fuga térmica y propagación entre baterías.
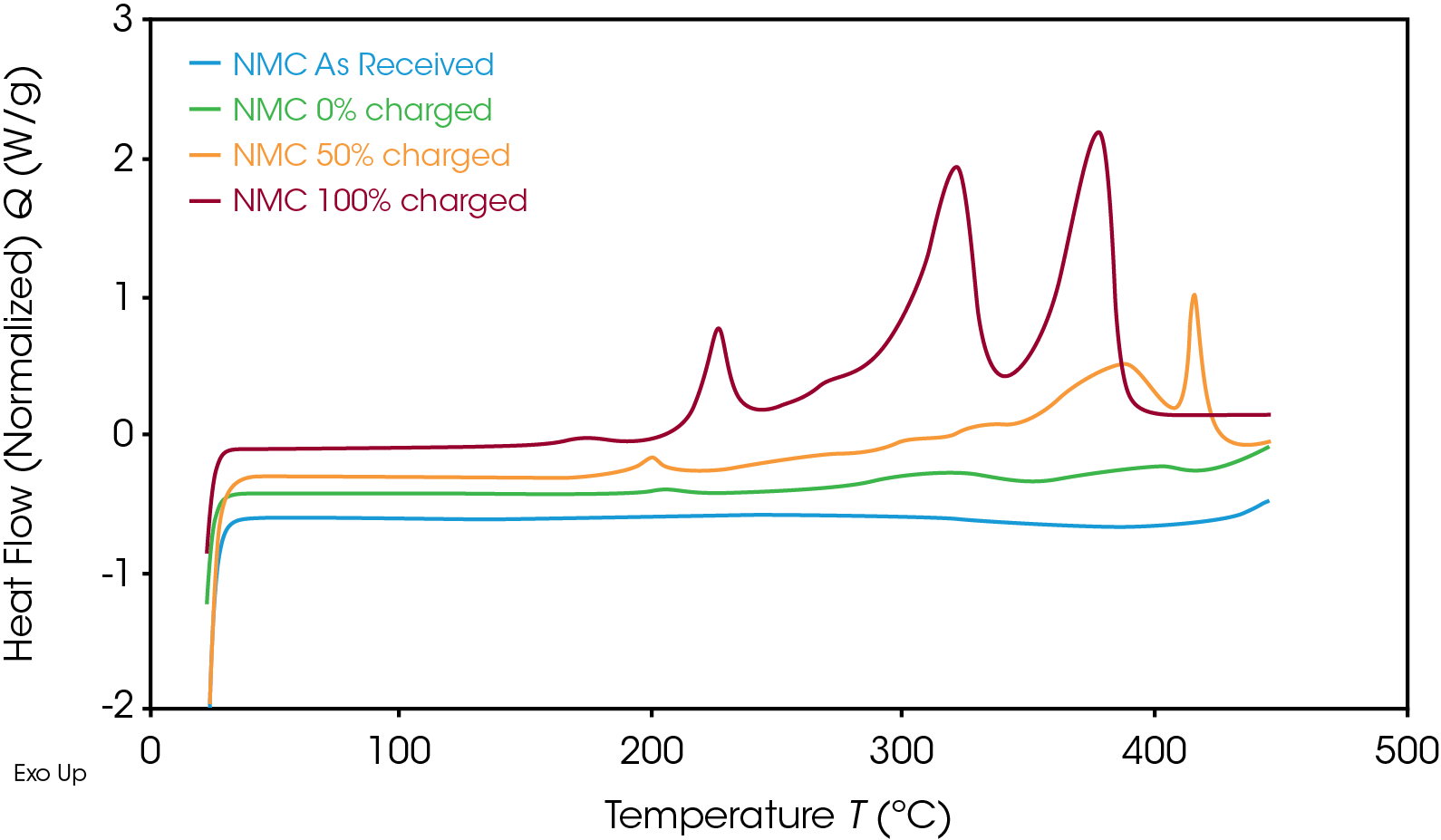
En la Figura 3 se muestra la señal de flujo de calor del cátodo de NMC a varios SOC. A medida que disminuyó el SOC, la estabilidad térmica aumentó. A un SOC del 50%, el máximo del evento exotérmico principal cambió de una temperatura de 378 °C a una más alta, de 416 °C, y liberó menos energía que a un SOC del 100%. El material de cátodo no cargado no experimentó reacciones exotérmicas.
Como era de esperarse, el ánodo siguió la misma tendencia, como se muestra en la Figura 4. Una vez que el SOC del ánodo disminuyó, el flujo de calor correspondiente también lo hizo. La reacción exotérmica liberó menos energía al SOC de 50% que al de 100%. En la Tabla 1 se muestra la entalpía por unidad de masa para ambos materiales a varios SOC.
Table 1. Enthalpy of reactions at various SOC for the NMC cathode and graphite anode
| Enthalpy (J/g) | Cátodo de NMC | Ánodo de grafito |
|---|---|---|
| 0% SOC | 72.1 | 49.8 |
| 50% SOC | 625 | 216 |
| 100% SOC | 1618 | 345 |
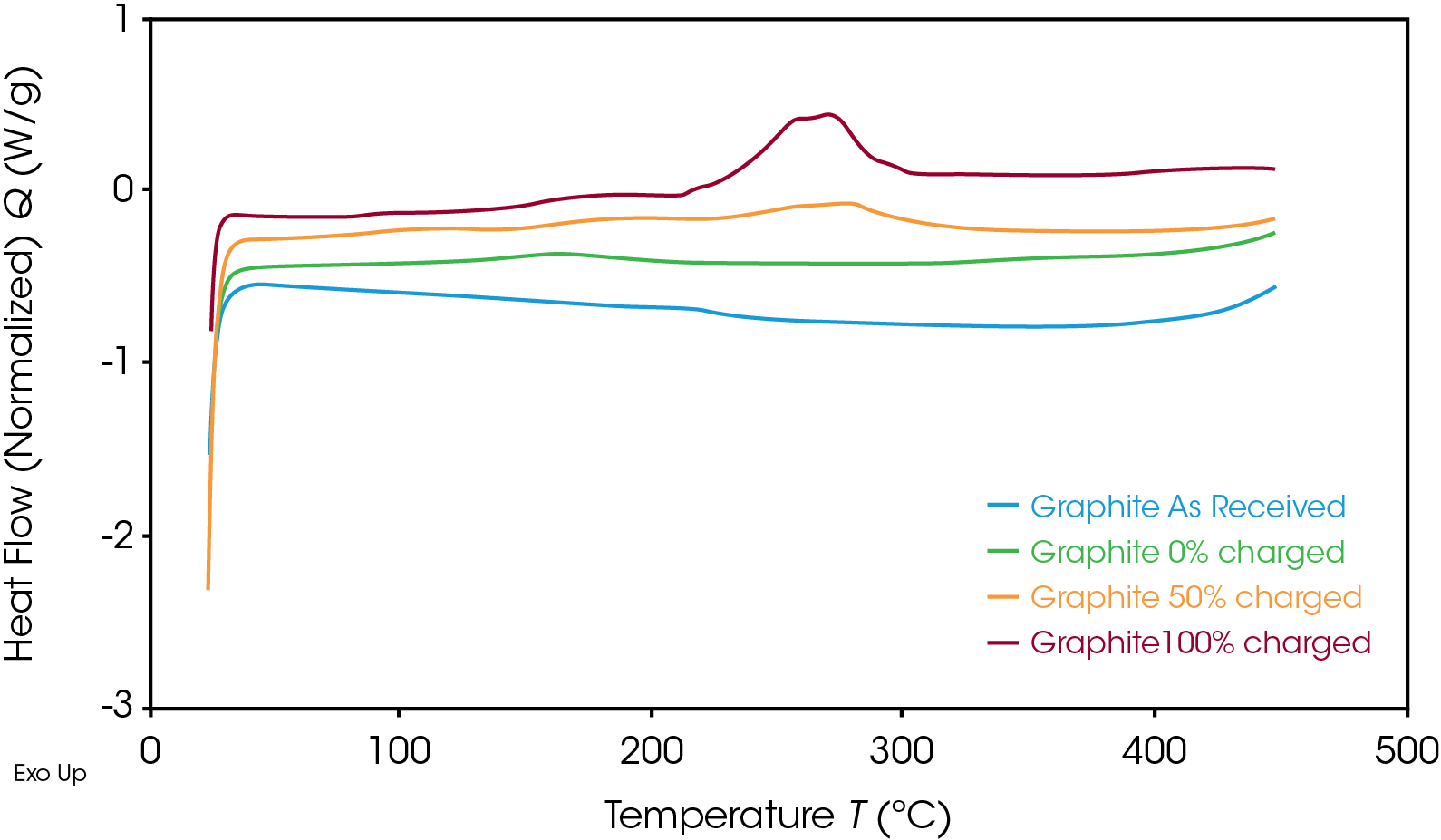
Cuando están descargados, la entalpía de reacción para el ánodo de grafito y el cátodo de NMC es similar. Sin embargo, para esta batería, la energía liberada en el ánodo de grafito cargado es significativamente menor que la del cátodo de NMC cargado, lo que muestra que el cátodo tiene un mayor riesgo de causar fuga térmica. Para esta batería, el cátodo cargado por completo libera más de tres veces la energía del ánodo cargado por completo; es más probable que esta liberación de energía impulse reacciones en la batería que conduzcan a una fuga térmica. Es importante que se estudien ambos electrodos para determinar cuáles materiales tienen los factores de riesgo más altos y qué temperaturas deben evitarse. La batería cargada por completo debe permanecer por debajo de la temperatura de inicio a fin de evitar la degradación insegura y la inestabilidad térmica. Los resultados del DSC ayudan a diseñar sistemas de gestión térmica mediante la comprensión de los parámetros de seguridad de los materiales de la batería.
Conclusiones
El DSC se puede utilizar para el análisis de seguridad de materiales de electrodo con respecto a la fuga térmica. Se puede determinar la temperatura de las reacciones que pueden dar pie a una fuga térmica, así como la cantidad de energía liberada durante las reacciones de degradación. Se analizaron electrodos a diferentes SOC (100%, 50%, 0%); el cátodo de NMC con SOC de 100% mostró el mayor riesgo de fuga térmica y propagación entre baterías. Cuando el SOC disminuyó al 50%, el NMC se hizo más estable térmicamente y la reacción exotérmica cambió a una temperatura más alta. El ánodo de grafito, mientras que siguió la misma tendencia con respecto al SOC, liberó mucha menos energía que el cátodo.
Referencias
- L. Torres-Castro, A. Kurzawski, J. Hewson and J. Lamb, “Passive mitgation of cascading propagation in multi-cell lithium ion batteries,” Journal of the Electrochemical Society, vol. 167, no. 9, 2020.
- A. W. Golubkov, S. Scheikl, R. Planteu, G. Voitic, H. Wiltsche, C. Stangl, G. Fauler, A. Thaler and V. Hacker, “Thermal runaway of commercial 18650 Li-ion batteries with LFP and NCA cathodes- impact of state of charge and overcharge,” RSC Advances, vol. 5, pp. 57171-57186, 2015.
- Z. Zhang, D. Fouchard and J. R. Rea, “Differential scanning calorimetry material studies: implications for the safety of lithium-ion cells,” Journal of Power Sources, vol. 70, pp. 16-20, 1998.
- X. Feng, M. Ouyang, X. Liu, L. Lu, Y. Xia and X. He, “Thermal runaway mechanism of lithium ion battery for electric vehicles :A review,” Energy Storage Materials, vol. 10, pp. 246-267, 2018.
- K. Kim, D. Kam, C. C. Nguyen, S.-W. Song and R. Kostecki, “Study on the Dominant Film-Forming Site Among Components of Li(Ni1/3Co1/3Mn1/3)O2 Cathode in Li-ion Batteries,” Bulletin of the Korean Chemical Society, vol. 32, no. 8, 2011.
Reconocimiento
Esta nota fue una colaboración entre NEI Corporation (Somerset, New Jersey) y TA Instruments. La redacción estuvo a cargo de la Dra. Jennifer Vail y el Dr. Hang Lau, Líderes Científicos de Desarrollo de Nuevos Mercados (New Market Development Scientific Lead) en TA Instruments.
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

