Optimización de Reacciones Catalíticas por TGA de Alta Presión
Frieder Dreisbach
March 28, 2022
Las reacciones catalíticas están en todas partes: desde plásticos y pan hasta más del 90% de todos los productos químicos en todo el mundo, se fabrican innumerables productos y materiales con la ayuda de catalizadores. 1 Los catalizadores son sustancias que aceleran las reacciones químicas lentas. Las reacciones más rápidas son tecnológica y económicamente más competitivas. Además, los catalizadores optimizados ofrecen un enorme potencial para reducir el consumo de energía y recursos y reducir las emisiones de dióxido de carbono.
Catálisis heterogénea
En aplicaciones industriales, la catálisis, o una reacción que usa un catalizador, se clasifica como , donde el catalizador está en la misma fase (generalmente líquida) que el reactivo, o heterogénea , donde a menudo un catalizador sólido reacciona con fluidos (gases). o líquidos) reactivos.
La catálisis heterogénea es un proceso de interfaz, es decir , el tamaño del área superficial del catalizador accesible influye en la velocidad de reacción. La mayoría de los materiales catalíticamente activos son partículas pequeñas con una gran relación superficie-masa, que ofrecen más reactividad con menos catalizador.
Los investigadores miden las velocidades de reacción en las condiciones de la aplicación para optimizar su proceso y aprovechar al máximo los costosos materiales catalizadores. Con materiales catalizadores de mejor rendimiento, las reacciones requieren menos catalizador y, por lo tanto, cuestan menos, reducen el consumo de energía y requieren menos recursos naturales para fabricar productos.
Pruebas de catalizadores a través de TGA de alta presión
El análisis termogravimétrico de alta presión (HP-TGA) permite a los investigadores investigar las reacciones entre un catalizador y un reactivo en fase gaseosa en condiciones de trabajo realistas a escala de laboratorio. Las condiciones de reacción pueden incluir alta presión, alta temperatura y mezclas de gases reactivos y vapor. La activación y desactivación de un catalizador por oxidación, reducción o coquización están asociadas a un cambio de peso y pueden medirse con alta resolución en el HP-TGA. Simultáneamente, el rendimiento y la cinética de la reacción pueden monitorearse mediante el análisis de gases desprendidos con espectrometría de masas en línea, cromatografía de gases, FTIR u otros métodos. Estos datos son extremadamente útiles para optimizar las condiciones de reacción y desarrollar mejores materiales catalizadores.
El instrumento HP TGA se puede utilizar como reactor catalítico mientras se controla el peso del catalizador. Esta configuración experimental permite a los investigadores identificar exactamente las condiciones que inducen reacciones catalíticas y cambios en el material del catalizador, como la activación o desactivación. La atmósfera de reacción del HP TGA puede consistir en gases reactivos comunes como hidrógeno, metano, etano, dióxido de carbono o monóxido de carbono y también vapor, y las condiciones experimentales pueden abarcar temperaturas de hasta 1100 °C y presiones de hasta 80 bar .
El principal beneficio de realizar reacciones catalíticas en fase gaseosa en catalizadores sólidos en un instrumento TGA es medir el peso del catalizador durante el experimento para detectar los procesos de activación o desactivación del catalizador de forma continua y cuantitativa a medida que ocurren.
Optimización del rendimiento y la productividad
Una clave para mejorar la eficiencia de las reacciones catalíticas es seleccionar las condiciones operativas óptimas para una reacción determinada. Los costos del producto y la huella ambiental se pueden reducir aún más mediante el desarrollo de procesos catalíticos que utilicen materias primas alternativas, que también requieren un control de proceso adaptado. 2
Ejemplo de optimización de las condiciones de catálisis: La metanización del dióxido de carbono es un proceso para generar metano por reducción con hidrógeno siguiendo la ecuación de reacción CO2 + 4 H2 ↔ CH4 + 2 H20. El hidrógeno de las energías renovables se puede utilizar para convertir el dióxido de carbono en metano verde como materia prima para el procesamiento químico. Esta reacción tiene una gran relevancia comercial como proceso clave en el concepto power-to-gas ( PtG ). En el ejemplo que se muestra aquí, se utiliza un catalizador de níquel con soporte de alúmina para la reacción de metanación, una serie de experimentos catalíticos con una mezcla de gases de 2 % de CO2, 8 % de H2 y 90 % de Ar. La dependencia de la presión y la temperatura del rendimiento de la reacción se controló a varias temperaturas entre 275 °C y 350 °C ya 1,5 bar, 15 bar y 30 bar usando un MS en línea. La Figura 2 compara el rendimiento de metano a las tres presiones monitoreando la traza de masa m/z 15, que indica la concentración de metano que es el producto objetivo de la reacción de metanación.
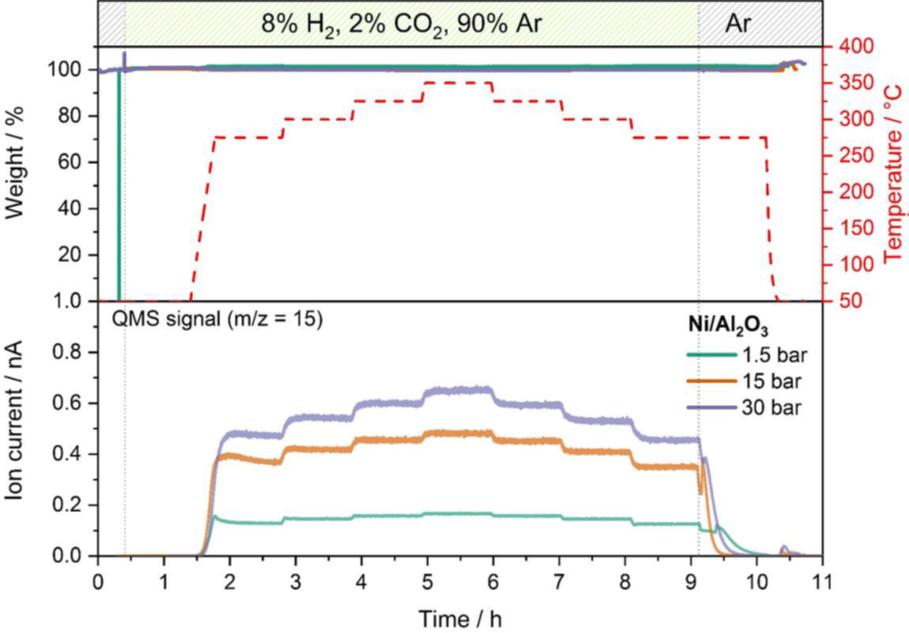
La comparación de los datos de MS a diferentes presiones y temperaturas revela que una mayor presión conduce a un mayor rendimiento de la reacción. La influencia de la temperatura en el rendimiento es similar, pero más pronunciada a 15 y 30 bar en comparación con la medición a 1,5 bar. No se detectó ningún cambio en el peso del catalizador a ninguna presión, lo que demuestra que no se produjo desactivación ni reacción secundaria.
Desactivación del catalizador
La desactivación del catalizador describe la pérdida de actividad o selectividad catalítica a lo largo del tiempo. Todos Los catalizadores se desactivan con el tiempo y deben ser reemplazados, pero el tiempo de operación antes de la desactivación puede variar ampliamente: depende del tipo de catalizador, el proceso y el mantenimiento de condiciones óptimas de operación, entre otros factores. Los catalizadores pueden desactivarse en unos pocos segundos u operar según lo programado durante varios años. 3 Para los procesos catalíticos industriales, la desactivación del catalizador es un riesgo económico importante. Cerrar procesos y reemplazar catalizadores le cuesta a la industria química miles de millones de dólares por año. 4
Existen mecanismos químicos, mecánicos y térmicos comunes para la desactivación de catalizadores que se pueden clasificar en diferentes tipos: es decir, envenenamiento, coquización o ensuciamiento y envejecimiento. 5, 6
Aunque la desactivación del catalizador suele ser inevitable a largo plazo, el comienzo de la desactivación prematura a menudo se puede evitar con medidas adecuadas de control del proceso 7 , que es objeto de investigación y desarrollo con el objetivo de diseñar procesos industriales y materiales catalizadores más robustos. 8 Como resultado, la desactivación puede retrasarse e incluso revertirse.
Evaluación de la coquización del catalizador
La desactivación de catalizadores debido a la formación de coque es un problema tecnológico y económico importante en la industria petroquímica y de refinación de petróleo. La resistencia mejorada de los catalizadores a la coquización se puede lograr usando otros metales catalíticamente activos y/o ajustando las condiciones de reacción, como la temperatura, la presión o la composición del gas. La optimización de materiales y procesos para la formación de coque requiere la medición de la cinética de desactivación del catalizador en condiciones reales de reacción. 9
Ejemplo de medición de la coquización: A continuación, se presenta una reacción de reformado con vapor a 700°C y 10 bar. La atmósfera de reacción consta de argón, metano y vapor con una proporción de vapor a metano de 4:1. Bajo estas condiciones, la generación de hidrógeno es detectada por MS en línea mientras el peso del catalizador permanece constante. Para evaluar el inicio de la coquización, la proporción de vapor a metano se cambia a 1:1 y luego a 1:2 ajustando los caudales de metano y vapor. La Figura 3 visualiza el peso del catalizador y la proporción de vapor a metano a lo largo del tiempo.
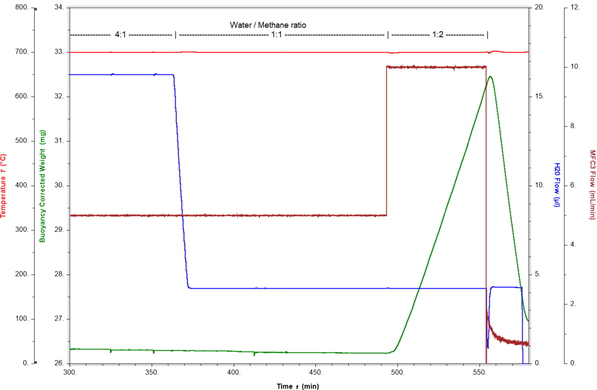
En proporciones de vapor a metano de 4:1 y 1:1, el peso del catalizador es estable. Cuando la relación se cambia a 1:2, el exceso de metano conduce inmediatamente a un rápido aumento de peso de 0,3 % p /min. Este aumento de peso es causado por la formación de coque (carbón elemental) en el catalizador. Este proceso de coquización se puede revertir y el catalizador se puede regenerar apagando el flujo de metano. Ahora, el vapor oxida el coque, lo que conduce a una tasa de pérdida de peso rápida de 0,9 % ( peso )/min. En solo 15 minutos, se eliminan más de 4 mg de coque de la superficie del catalizador. Esto prueba la reversibilidad del proceso si las condiciones de reacción se ajustan lo suficientemente rápido. La figura 4 muestra que la coquización puede conducir a la formación de cantidades impresionantes de carbono si las condiciones de reacción no se cambian rápidamente después de que comienza la formación de coque.

La catálisis optimizada está a solo un experimento de distancia
Como demuestran los ejemplos y técnicas anteriores, la catálisis se puede mejorar seleccionando el mejor catalizador y reactivos, optimizando las condiciones de reacción y evitando, retrasando o revirtiendo la desactivación. Las reacciones catalíticas mejoradas ofrecen una mayor sostenibilidad al tiempo que reducen los costos.
La TGA de alta presión es un método líder para estudiar el rendimiento del catalizador y optimizar las reacciones catalíticas heterogénicas. Las reacciones en fase gaseosa, como la metanación, el reformado con vapor y muchas otras reacciones importantes desde el punto de vista técnico y comercial, se pueden realizar en un instrumento HP-TGA en condiciones relevantes de presión, temperatura y composición de gas o vapor. El volumen de negocios de la reacción se puede controlar mediante análisis EGA con espectrometría de masas, FTIR u otros métodos adecuados y la señal del peso del catalizador proporciona valiosos datos en línea sobre los procesos de activación y desactivación.
¿Quiere saber más sobre el potencial de TGA para optimizar procesos y materiales catalíticos? Revise nuestra nota de aplicación sobre el tema o vea los seminarios web grabados sobre TGA en condiciones extremas u optimización de catalizadores con métodos TGA . No dude en ponerse en contacto con los expertos de TA Instruments para analizar sus necesidades de prueba y explorar la instrumentación ideal para su laboratorio.
Referencias:
- Ma, Z. and Zaera, F., Heterogeneous Catalysis by Metals, in King, R. Bruce; Crabtree, Robert H.; Lukehart, Charles M.; Atwood, David A. (eds.), Encyclopedia of Inorganic Chemistry, John Wiley & Sons, Ltd.
- Anderson, N., (2000), Practical Process Research & Development, Optimizing Catalytic Reactions, 185-201.
- Bartholomew, C.H., Mechanisms of catalyst deactivation, Applied Catalysis A: General 212 (2001) 17–60.
- Boskovic G., Baerns M. (2004), Catalyst Deactivation, in: Baerns M. (eds) Basic Principles in Applied Catalysis. Springer Series in Chemical Physics, vol 75. Springer, Berlin, Heidelberg.
- Figuerido, J.L. (Ed.), Progress in Catalyst Deactivation, NATO Advanced Study Institute Series E, Marunus Nijhoff, Boston, 1982.
- Hughes, R., Deactivation of Catalysts, Academic Press, London, 1984 (Chapter 8).
- Oudar, J. and Wise, H., Deactivation and Poisoning of Catalysts, Marcel Dekker, New York, 1985, 1.
- Butt, J.B., Petersen, E.E., Activation, Deactivation, and Poisoning of Catalysts, Academic Press, San Diego, 1988.
- Wolf, E. E. and Alfani, F., (1982), Catalysts Deactivation by Coking, Catalysis Reviews, 24:3, 329-371

