キーワード: DSC、MDSC、リチウムイオン電池、電解質、低温
TA468-JA
要約
リチウムイオン電池の電解質は、イオン輸送と電池性能を最適にするために液体状態を保つ必要があります。電解質の相転移を理解することは、低温でのバッテリー性能、特に寒冷気候下の性能を向上させるために重要です。示差走査熱量測定(DSC)は、電解質の結晶化と融解を評価するための単純な測定法を提供します。高濃度の電解質は過冷却され、急速冷却下で液体状態を維持し、その結果、加熱時に結晶化する可能性があります。このような冷結晶化と融解は、同じ温度範囲で重複する可能性があり、従来のDSC実験では完全に分析することが不可能です。温度変調DSCは、結晶化を非可逆熱流量信号に、融解を可逆熱流量信号に分離します。これにより、結晶化と融解に関連するエンタルピーの明確かつ正確な積分を個別に行うことが可能になり、温度範囲にわたる相転移機構のさらなる洞察を提供します。本研究では、バッテリー性能を左右し得る低温での転移を理解するために、2種類の市販の電解質を評価します。
はじめに
リチウムイオン電池(LIB)の電解液は、イオンがカソードとアノードとの間を流れてバッテリーが充放電することを可能にします。重要な課題は、さまざまな動作条件で安定性と長寿命を維持しながら、高エネルギー密度を達成することです。電解液は、水溶液または有機溶液中に、塩、最も一般的にはLiPF6を含有します[1]。エチレンカーボネート(EC)、エチルメチルカーボネート(EMC)、ジメチルカーボネート(DMC)がよく使用されますが、より高い電圧では酸化のため使用が制限される場合があります。添加剤を入れると、高電圧が可能になると同時にEC濃度の制限に役立ち、低温操作に恩恵をもたらします[2][3]。
LIBに関する一般的なデメリットは、低温で効率が低下することです。電解液が凍結すると、イオン輸送が減少し、バッテリーの性能に影響します。電解液を分析して低温での相転移を特定することは、貴重な調合ツールを提供し、動作条件下でのバッテリー性能を予測するのに役立ちます。示差走査熱量測定(DSC)は、材料の相転移中の熱流変化を測定するための簡単な方法を提供します。TAインスツルメントのDiscovery DSCを使用すると、従来のDSCおよび温度変調DSC (MDSC)試験を実行して、結晶化、融解温度、相転移のエンタルピーなど、電解液の相転移を理解することが可能になります。
従来のDSCは、試料中の直線的に傾斜する温度の関数として熱流を測定します。MDSCは、平均昇温速度に正弦波の変調を加えることによって、従来のDSC試験にさらなる洞察を追加します[4] [5]。MDSCの可逆信号は、昇温速度に対するヒートフロー反応であり、熱容量(Cp)、熱容量の変化、結晶融解を測定します。非可逆信号は、絶対温度および時間に対するヒートフロー反応を測定し、結晶化、分解、蒸発、分子の緩和、化学反応などの運動過程を取得します。MDSC測定から複雑な転移を特定の成分へ分解することができるため、データ解釈が向上します。このノートでは、TAインスツルメントの示差走査熱量計(DSC)を使用して、LIB電解質の従来の測定とMDSC測定の両方を実行し、温度の関数として相転移を理解します。
実験
市販の2種類の電解質は、SpectraPower(Livermore、米国カリフォルニア州)によって提供され、本研究では電解質A及び電解質Bと称されます。Tzeroテクノロジーを使用したTAインスツルメントのDSCで、電解質試料の加熱中および冷却中の熱流量信号を測定しました。約10 mg の試料をグローブバッグ内で調製し、Tzero密封パンに密封しました。試料をまず-120℃に冷却し、次に10℃/分で-120℃から40℃まで昇温させて、電解質の凍結と融解を評価しました。結晶化温度と融解温度の開始およびピーク、ならびに相転移のエンタルピーを測定しました。
MDSCは、60秒の温度変調周期と-120℃~40℃まで2℃/分の加熱傾斜で、表1に示されるModulated Heat Only(温度変調条件として昇温状態を保つ)法を使用して実施しました。
表1. MDSC(温度変調条件として常に昇温状態を保つ)手順
| 試験 | 温度変調条件として常に昇温状態を保つ |
|---|---|
| 温度変調周期 | 60 sec |
| 傾斜率 | 2 °C/min |
| 開始温度 | -120 °C |
| 最終温度 | 40 °C |
結果および考察
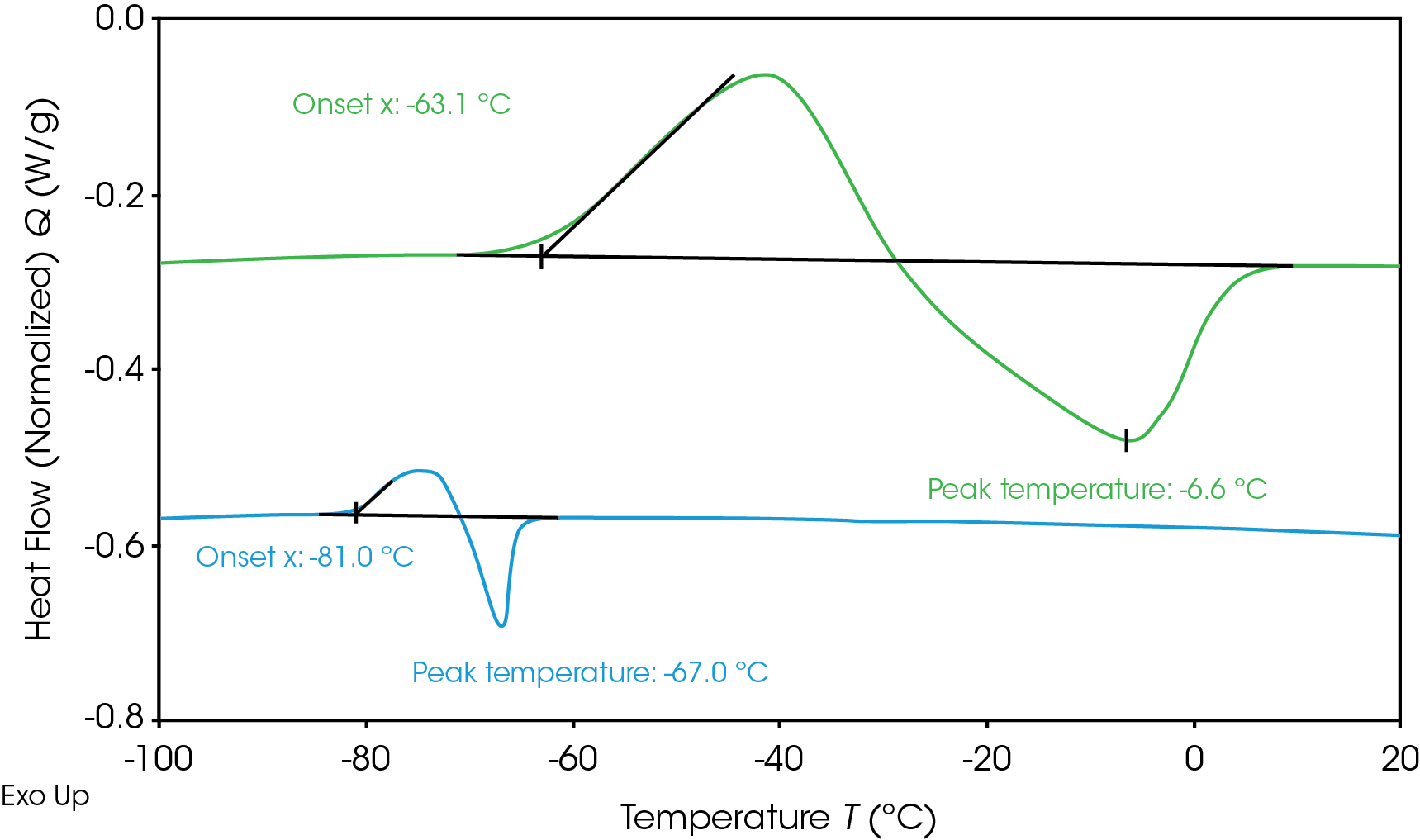
電解質の相転移を決定することは、低温でのバッテリー動作中の凍結を防止するのに役立ちます。DSCによって測定した凍結および解凍中の電解質熱流量を図1に示します。電解質を-120 ℃まで冷却してから、その後加熱して相転移を測定しました。いずれの電解質も冷却中に結晶化を示さず、過冷却溶液をもたらしたものの、両方とも加熱時に結晶化しました(冷結晶化)[6]。電解質A(緑)は、
-63.1℃で結晶化開始を示し、-6.6℃で融解ピークを示しました。電解質B(青)は、-81℃とより低い結晶化開始を示し、-67℃で融解ピークを示しました。電解質がより広い温度範囲にわたって液体状態のままになるため、より低い温度で動作するには、融解温度が低いほうが望ましいと言えます。電解質が凍結して結晶化すると、リチウムイオンの移動度が制限され、バッテリーの性能に影響を与えます。凍結転移に影響を与えるように電解質の調合を調整したり、電池が凍結開始温度に達しないように熱管理システムを調整したりすることができます。
凍結および融解中に電解質Aが受ける重複転移は、MDSCによってさらに理解することができます。MDSCで昇温状態を保つ場合は、結晶化が誘発冷却により影響されるのを防ぐために、変調温度は一切低下せず、試料は一切冷却しません[7]。MDSCは、重複する結晶化および融解転移(図1)を分離して、結晶化を非可逆熱流量信号で、融解を可逆熱流量信号で、区別するようにしました(図2)。この分離により、結晶化と融解に関連するそれぞれのエンタルピーの明確な積分が可能になります。その結果、電解質Aの結晶化エンタルピーは28.8 J/gであるとともに融解エンタルピーも28.8 J/gであり、これは、すべての結晶性が加熱中の冷結晶化の際に形成されたことを示しています。10℃/分での従来のDSCと比較して、MDSCで使用される2℃/分の遅い昇温速度もまた、分解能を向上させ、追加の結晶化ピークが-63.7℃と
-52.7℃で示されています。融解は、主要結晶化の直後に起こり、-5.6℃でピークに達しています。
図3に示される電解質Bは、結晶化と融解の2つの個別のピークを有しています。電解質Aと同様に、電解質Bの類似した総結晶化エンタルピー(21.3 J/g)と総融解エンタルピー(21.3 J/g)は、すべての結晶材料が加熱中の冷結晶化の際に形成されたことを示しています。電解質Bの結晶化と融解の機構をさらに評価するために、総エンタルピーを2つに分離することができます。
TRIOSソフトウェアは、「divide peak」(分割ピーク)機能により積分を分析して、各局所エンタルピーおよび面積パーセントを示し、結晶化および融解の各イベント中に発生した個々のエンタルピーの量を明らかにすることができます。表2に示すように、融解と結晶化の合計エンタルピーは同じであっても、1回目の結晶化(14.9 J/g)とその後の融解(12.8 J/g)のエンタルピーは等価ではありません。その後に結晶化(6.5 J/g)が起こり、最終融解(8.5 J/g)に続いています。これは、材料の不均一な結晶化と融解を示しています。プロセスの温度全体にわたって、所与の温度で異なる相があり、この分析は相転移機構の洞察を提供しています。
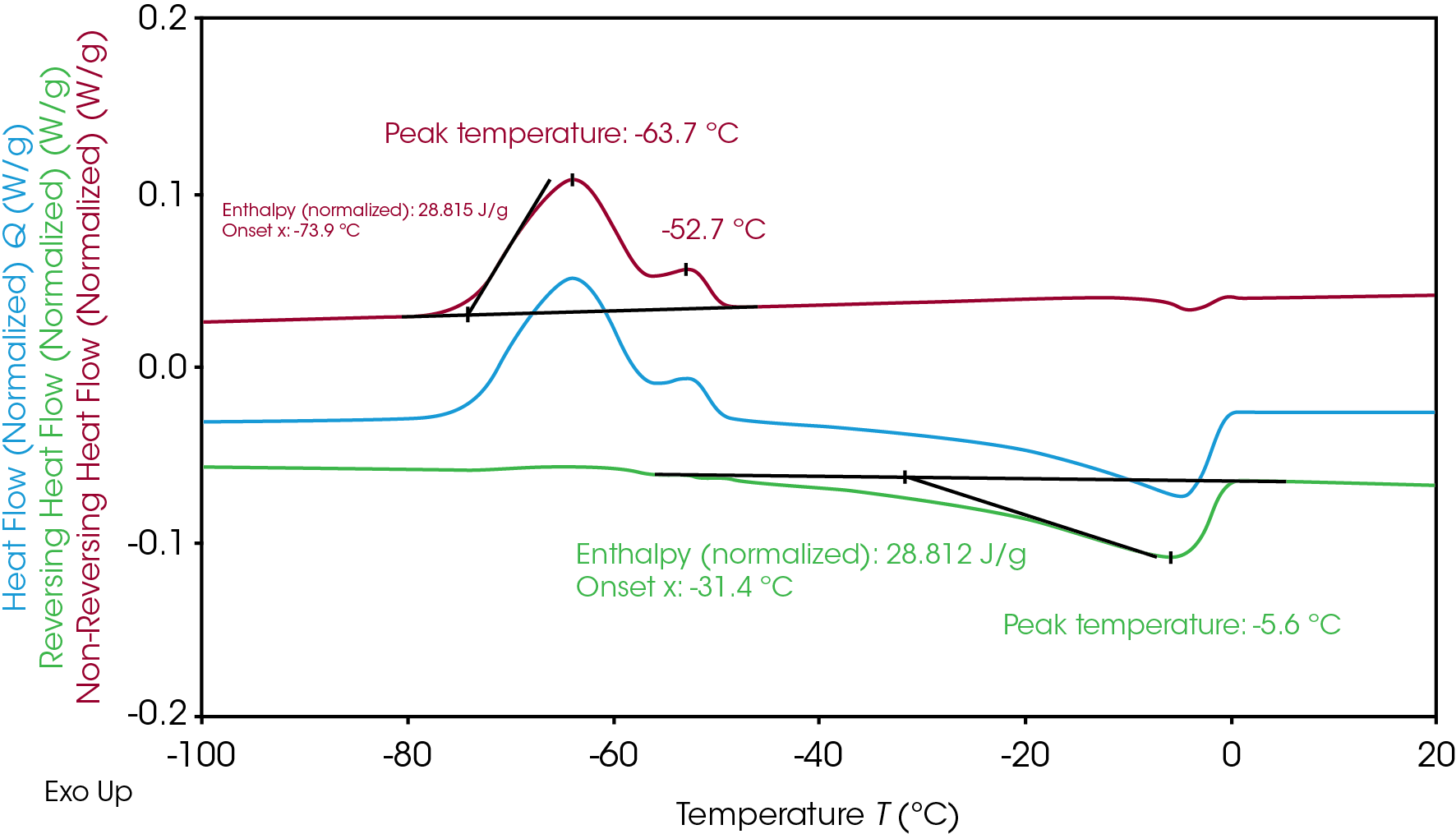
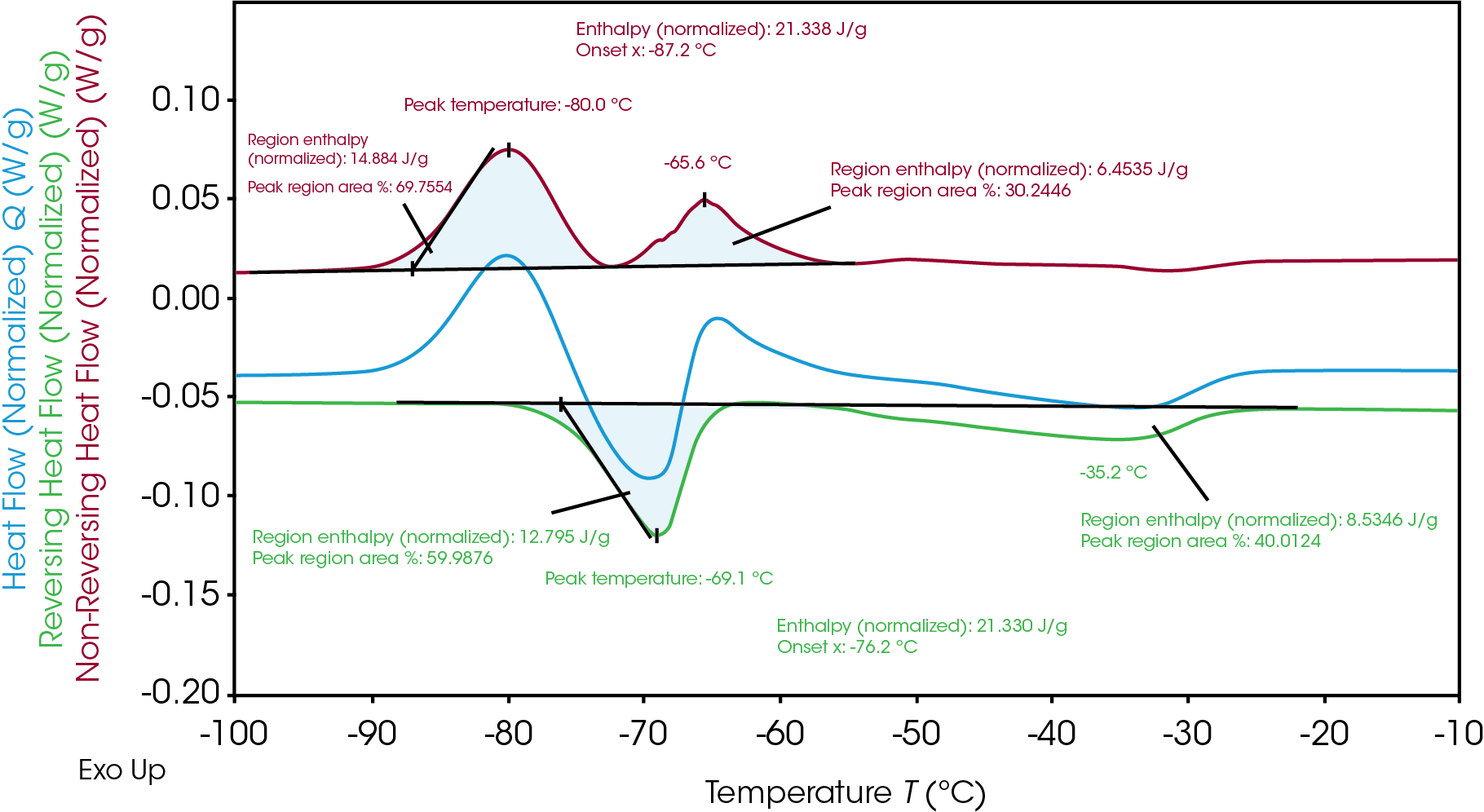
表2. 電解質Bの結晶化・融解エンタルピーの分類
| 温度(°C) | エンタルピー(J/g) | 熱流量信号 | |
|---|---|---|---|
| 1回目の結晶化 | -80.0 | 14.9 | 非可逆 |
| 1回目の融解 | -69.1 | 12.8 | 可逆 |
| 2回目の結晶化 | -65.6 | 6.5 | 非可逆 |
| 2回目の融解 | -35.2 | 8.5 | 可逆 |
おわりに
電解質の相転移を理解することは、低温でのリチウムイオン電池の性能にとって重要です。示差走査熱量測定は、電解質の熱流量を測定し、凍結・融解温度の開始温度を決定するために使用することができます。MDSCは、時には同じ温度範囲で生じる結晶化転移と融解転移を分離する利点を提供します。この技術を通じて、研究者は低温でのバッテリー性能を向上させるための新しい調合を研究することができ、製造者は電解質の品質管理のためにDSCを使用することができます。
参考文献
-
- H. Yang, G. V. Zhuang and P. N. Ross Jr., “Thermal Stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6,” Journal of Power Sources, vol. 161, pp. 573-579, 2006.
- E. R. Logan, E. M. Tonita, K. L. Gering, L. Ma, M. K. G. Bauer, J. Li, L. Y. Beaulieu and J. R. Dahn, “A Study of the Transport Properties of Ethylene Carbonate-Free Li Electrolytes,” Journal of the Electrochemical Society, vol. 165, no. 3, 2018.
- O. Lavi, S. Luski, N. Shpigel, C. Menachem, Z. Pomerantz, Y. Elias and D. Aurbach, “Electrolyte Solutions for Rechargeable Li-Ion Batteries based on FLuorinated Solvents,” ACS Applied Energy Materials, vol. 3, pp. 7845-7499, 2020.
- L. C. Thomas, “TP006 Modulated DSC® Paper #1: Why Modulated DSC®? ; An Overview and Summary of Advantages and Disadvantages Relative to Traditional DSC,” TA Instruments, New Castle, DE.
- TA Instruments, “TN34 Thermal Applications Note: Modulated DSCTM: A Simple Technique With Significant Benefits,” TA Instruments, New Castle, DE.
- L. A. Robertson, Z. Li, Y. Cao, I. A. Shkrob, M. Tyagi, K. C. Smith, L. Zhang, J. S. Moore and Y. Z, “Observation of Microheterogeneity in Highly Concentrated Nonaqueous Electrolyte Solutions,” Journal of the American Chemical Society, vol. 141, no. 20, pp. 8041-8046, 2019.
- TA Instruments, “TN045: Choosing Conditions in Modulated DSC®,” TA Instruments, New Castle, DE.
謝辞
このノートは、TA Instruments社のJennifer Vail博士とHang Lau博士が執筆しました。
このアプリケーションノートの印刷用バージョンをダウンロードするにはこちらをクリックしてください。

