通過高壓TGA法優化催化反應
Frieder Dreisbach
March 28, 2022
催化反應無處不在:從塑膠和麵包到全世界90%以上的化學品,無數的商品和材料都是在催化劑的幫助下生產的。1 催化劑是加速緩慢化學反應的一種物質。更快的反應在技術和經濟上都更具競爭力。此外,優化後的催化劑在降低能源和資源消耗以及降低二氧化碳排放方面具有巨大潛力。
多相催化
在工業應用中,催化或使用催化劑的反應分為兩類,一類是催化劑與反應物處於同一(通常為液相)相,另一類是非均相,其中固體催化劑通常與流體(氣體或液體)反應物反應。
多相催化是一個介面過程,即可接近催化劑表面積的大小影響反應速率。大多數催化活性材料都是具有較大表面品質比的小顆粒,用較少的催化劑即可實現更大的反應。
研究人員通過測量應用條件下的反應速率來優化工藝,並最大限度地利用昂貴的催化劑材料。使用性能更好的催化劑材料,反應所需的催化劑更少,因此成本更低,能耗更低,生產產品所需的自然資源更少。
通過高壓TGA測試催化劑
高壓熱重分析(HP-TGA)助力研究人員在實驗室規模的實際工作條件下研究催化劑與氣相反應物之間的反應。反應條件包括高壓、高溫和反應性氣體混合物和蒸汽環境。通過氧化、還原或結焦啟動和失活催化劑與重量變化有關,可在HP-TGA中以高解析度測量。同時,反應的產率和動力學可以通過線上質譜、氣相色譜、FTIR或其他方法的逸出氣體分析進行監測。這些資料對於優化反應條件和開發改進的催化劑材料非常有幫助。
HP TGA儀器可用作催化反應器,同時監測催化劑重量變化。這種實驗裝置能夠説明研究人員準確地確定引發催化反應的條件以及催化劑材料的變化,如活化或失活。HP TGA的反應氣氛可以包括常見的反應氣體,如氫氣、甲烷、乙烷、二氧化碳或一氧化碳,以及蒸汽,以及高達1100°C的溫度和高達80巴壓力的實驗條件。
在TGA儀器中對固體催化劑進行催化氣相反應的主要好處是在實驗過程中測量催化劑重量,以連續、定量地檢測催化劑的活化或失活過程。
優化產量和生產率
提高催化反應效率的關鍵是為給定的反應選擇最佳的操作條件。通過開發使用替代原料的催化工藝,可以進一步降低產品成本和環境影響,這也需要調整工藝控制。2
優化催化條件示例:二氧化碳的甲烷化是一個通過與氫氣還原產生甲烷的過程,其反應方程式為:CO2 + 4 H2 ↔ CH4 + 2 H20。來自可再生能源的氫氣可以用來將二氧化碳轉化為綠色甲烷,從而將其化學加工原料使用。作為電轉氣(PtG)概念中的一個關鍵過程,這一反應具有高度重要的商業意義。在這一示例中,氧化鋁支持的鎳催化劑被用於甲烷化反應的一系列催化實驗,其混合氣體為2%的CO2、8%的H2和90%的Ar的混合物。通過線上質譜儀,在275°C和350°C之間的不同溫度以及1.5巴、15巴和30巴的條件下,監測反應產量的壓力和對溫度依賴性。圖2對監測品質跟蹤m/z 15在三個壓力下的甲烷產量進行了對比,顯示了甲烷化反應的目標產物甲烷濃度。
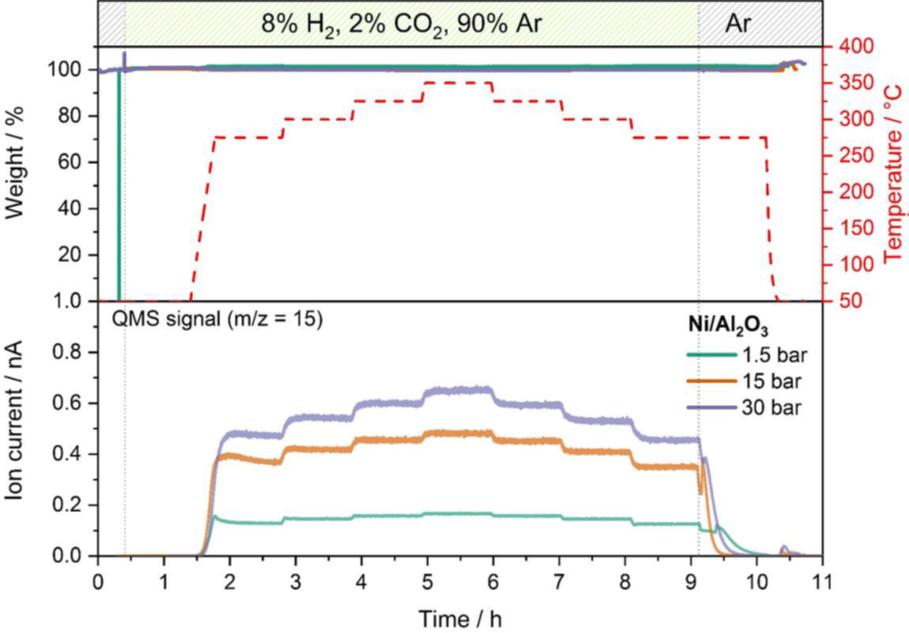
通過比較不同壓力和溫度下的質譜資料表明,壓力越高,反應產率越高。溫度對產率的影響類似,但在15和30巴時比在1.5巴時更為明顯。在任何壓力下均未檢測到催化劑重量變化,證明未發生失活或副反應。
催化劑失活
催化劑失活是指隨著時間的推移,催化劑活性或分離性的損失。所有催化劑都會隨著時間的推移而失活,必須更換,但失活前的操作時間可能會有很大的變化:這取決於催化劑的類型、工藝和最佳操作條件的維持時間等因素。催化劑可以在幾秒鐘內失活或按計劃運行數年。3對於工業催化過程,催化劑失活是一個主要的經濟風險。停止流程以及更換催化劑每年給化學工業造成數十億美元的損失。4
催化劑失活包括常見的化學、機械和熱機制,可分為不同類型:即中毒、結焦或結垢和老化。5, 6
儘管從長遠來看,催化劑失活通常是不可避免的,但往往可以通過適當的工藝控制措施來避免過早失活,7 這是研究和開發的主題,其目標是設計更強大的工業工藝和催化劑材料8,從而推遲甚至逆轉催化劑失活。
催化劑結焦評估
結焦導致的催化劑失活是石油精煉和石化工業中的一個重要的技術和經濟問題。通過使用其他催化活性金屬和/或調整反應條件,如溫度、壓力或氣體成分,可以提高催化劑的抗結焦性。優化結焦形成的材料和工藝需要測量真實反應條件下的催化劑失活動力學。
結焦測量示例:在700°C和10巴下的蒸汽重整反應如下所示。反應氣氛由氬、甲烷和蒸汽組成,蒸汽與甲烷的比例為4:1。在這些條件下,在催化劑重量保持不變的情況下,通過線上MS檢測氫氣生成量。通過調整甲烷和蒸汽流量,將蒸汽與甲烷的比率改為1:1,然後改為1:2,以評估結焦的起始點。圖3顯示了催化劑重量和蒸汽與甲烷的比率隨時間的變化。
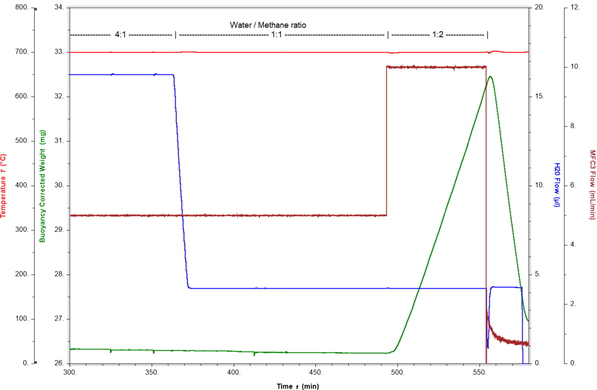
當蒸汽與甲烷的比例為4:1和1:1時,催化劑重量保持穩定。當比例改變為1:2時,過量的甲烷立即導致重量快速增加0.3%wt/min。這種重量增加是由催化劑上形成結焦(元素碳)引起的。這種結焦過程可以逆轉,通過關閉甲烷流,催化劑可以再生。現在,通過蒸汽氧化焦炭,導致快速失重率為0.9%(wt)/min。僅在15分鐘內,就從催化劑表面去除了超過4 mg的焦炭。這證明了如果反應條件調整得足夠快,結焦過程便是可逆的。圖4顯示,如果在結焦開始後反應條件沒有迅速改變,結焦會導致大量碳的形成。

優化催化只是一個實驗
正如上面的例子所表明的,可以通過選擇最佳的催化劑和反應物,優化反應條件,以及避免、延遲或逆轉失活來改善催化作用。強化的催化反應在降低成本的同時提供了更大的可持續性。
高壓TGA是研究催化劑性能和優化異質催化反應的一種領先方法。氣相反應,如甲烷化、蒸汽重整和許多其他重要的技術和商業反應都可以在HP-TGA儀器中在相關的壓力、溫度和氣體或蒸汽成分條件下進行。反應周轉率可以通過EGA分析與質譜、FTIR或其他合適的方法進行監測,催化劑重量信號提供了關於活化和失活過程的寶貴線上資料。
您想進一步瞭解TGA在優化催化材料和工藝方面的潛力嗎?請查看我們關於該主題的應用b報告,或觀看關於極端條件下通過TGA儀器應用或通過TGA優化催化劑的網路研討會視頻。請隨時聯繫TA Instruments的專家諮詢您的測試需求,探討實驗室的理想儀器。
參考文件:
- Ma, Z. and Zaera, F., Heterogeneous Catalysis by Metals, in King, R. Bruce; Crabtree, Robert H.; Lukehart, Charles M.; Atwood, David A. (eds.), Encyclopedia of Inorganic Chemistry, John Wiley & Sons, Ltd.
- Anderson, N., (2000), Practical Process Research & Development, Optimizing Catalytic Reactions, 185-201.
- Bartholomew, C.H., Mechanisms of catalyst deactivation, Applied Catalysis A: General 212 (2001) 17–60.
- Boskovic G., Baerns M. (2004), Catalyst Deactivation, in: Baerns M. (eds) Basic Principles in Applied Catalysis. Springer Series in Chemical Physics, vol 75. Springer, Berlin, Heidelberg.
- Figuerido, J.L. (Ed.), Progress in Catalyst Deactivation, NATO Advanced Study Institute Series E, Marunus Nijhoff, Boston, 1982.
- Hughes, R., Deactivation of Catalysts, Academic Press, London, 1984 (Chapter 8).
- Oudar, J. and Wise, H., Deactivation and Poisoning of Catalysts, Marcel Dekker, New York, 1985, 1.
- Butt, J.B., Petersen, E.E., Activation, Deactivation, and Poisoning of Catalysts, Academic Press, San Diego, 1988.
- Wolf, E. E. and Alfani, F., (1982), Catalysts Deactivation by Coking, Catalysis Reviews, 24:3, 329-371

