Palabras clave: calorimetría isotérmica, TAM, flujo de calor, baterías de iones de litio, aditivos electrolíticos, calor parasítico
MC162-ES
RESUMEN
La microcalorimetría isotérmica es un método simple para determinar el efecto que tiene un aditivo electrolítico o una combinación de aditivos sobre las reacciones parasíticas que ocurren en una batería de iones de litio como una función del estado de carga. En este estudio, se utilizó un microcalorímetro TAM de alta resolución equipado con 12 microcalorímetros para medir y comparar cuantitativamente el flujo de calor de baterías de iones de litio que solo varían en la concentración del aditivo electrolítico. En este caso, siendo todas las demás fuentes idénticas, la diferencia medida en el flujo de calor es un resultado directo de la diferencia en el calor parasítico debido al aditivo. Esto se hace como una función del estado de carga, lo que proporciona un método simple y rápido para determinar exactamente dónde y en qué medida el aditivo electrolítico está reduciendo las reacciones parasíticas. Como ejemplo demostrativo, se examina el efecto de concentraciones variables de carbonato de vinileno (VC) en una celda de LiCoO2/grafito. Se muestra que la presencia de VC reduce las reacciones parasíticas por encima de 3.9 V y continúa reduciendo estas reacciones al aumentar el estado de carga. El método y los datos presentados en este documento han sido publicados (Referencia 1) y se reproducen con permiso. ©2013, The Electrochemical Society.
INTRODUCCIÓN
Las baterías de iones de litio se utilizan en un número cada vez mayor de aplicaciones que exigen mayores densidades de energía y vidas más largas. El uso de aditivos para electrolitos es un método común que ha demostrado extender el calendario y el ciclo de vida y reducir las reacciones parasíticas que ocurren entre el electrolito y los materiales del electrodo. Sin embargo, no se comprende muy bien cómo funcionan estos aditivos y exactamente en qué parte del ciclo de carga-descarga resultan ventajosos. Por lo tanto, es de gran interés poder determinar la ventaja dependiente del voltaje de un aditivo o combinación de aditivos en particular, lo que puede ayudar a comprender cómo estos aditivos extienden la vida útil de las baterías de iones de litio.
Recientemente, la técnica de microcalorimetría isotérmica se ha combinado con mediciones electroquímicas, que se han utilizado para examinar el comportamiento térmico de varias químicas de iones de litio2-9. Más recientemente, Krause et al10 mostraron cómo utilizar esta técnica para separar las distintas contribuciones a la energía térmica y aislar la energía parasítica. Aquí, esta técnica se utiliza para comparar cualitativa y cuantitativamente el flujo de calor entre celdas que solo varían en la concentración de aditivo. En este caso, siendo todas las demás fuentes idénticas, la diferencia medida en el flujo de calor surge de diferencias en el calor parasítico. Esto se hace como una función del estado de carga, proporcionando un método simple y rápido para determinar exactamente dónde y en qué medida el aditivo está reduciendo las reacciones parasíticas que ocurren entre el electrolito y los materiales del electrodo. Como ejemplo demostrativo, se examina el efecto de concentraciones variables de carbonato de vinileno (VC) en una celda de LiCoO2/grafito, donde el VC es un aditivo de electrolitos ampliamente utilizado que ha demostrado extender la vida útil de las celdas.11.
Experimental
Se proporcionaron en seco celdas de bolsa de grafito/LiCoO2 (LCO) de 225 mAh fabricadas a máquina (obtenidas de Pred Materials Co.). Las bolsas se llenaron con 0.75 g de electrolito compuesto por 1M LiPF6 en 3:7 de carbonato de etileno: carbonato de etilmetilo (Novolyte Technologies, ahora BASF) con varias cantidades de aditivo VC (Novolyte Technologies, ahora BASF) (0%, 0.5%, 2%, y 4% por peso) y luego sellados al vacío. Los electrodos se humedecieron centrífugamente usando una aceleración de 50 gravedades durante 20 minutos. Después se formaron las celdas, donde se mantuvieron a 1.5 V durante 24 horas a 40 °C, y luego se cargaron a 2 mA durante 10 horas, luego se cargaron de 15 mA a 4.2 V y luego se descargaron de 15 mA a 3.775 V. Entonces, las celdas se abrieron para liberar el gas producido y se volvieron a sellar. La carga y descarga de las celdas dentro del microcalorímetro se realizó utilizando un sistema de prueba automatizado Maccor serie 4000 (Maccor Inc.).
Las mediciones de microcalorimetría del flujo de calor isotérmico se realizaron con un calorímetro TAM (TA Instruments-Waters LLC), con una incertidumbre de medición de < ±1.0 μW y a una temperatura de 40.0 °C. Los detalles de la calibración y operación del instrumento, la información general y los métodos se analizan en detalle en la Referencia 10. El nivel de ruido del instrumento es de aproximadamente 10 nW y la desviación de la línea base fue inferior a 500 nW durante el período de los experimentos realizados aquí. [/vc_column_text][/vc_column][/vc_row][vc_row][vc_column][vc_column_text]
RESULTADOS Y DISCUSIÓN
Flujo de calor durante el ciclado
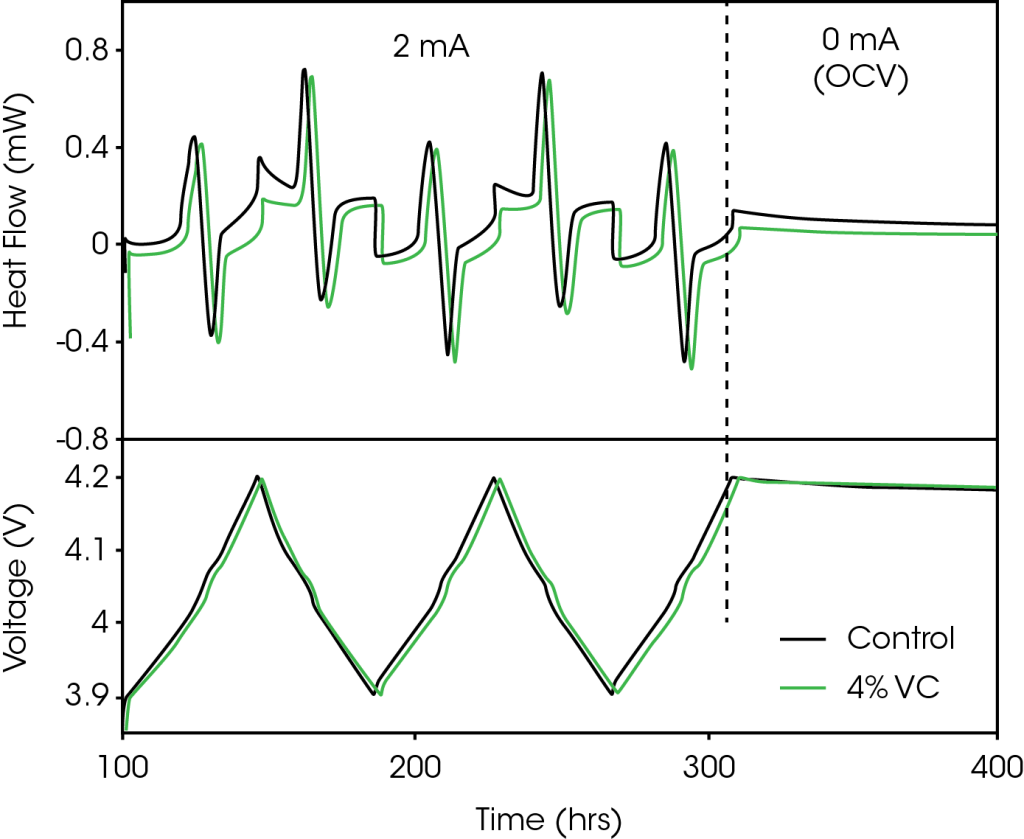
La Figura 1 muestra un segmento representativo del protocolo de ciclado utilizado para las células analizadas dentro del microcalorímetro. La Figura 1a muestra el flujo de calor medido y la Figura 1b muestra el perfil de voltaje correspondiente. Para simplificar, solo se muestran los datos de la celda de control (sin VC) y la celda que contiene 4% de VC. El protocolo de ciclado tiene dos segmentos distintos, como se destaca con una línea discontinua vertical en la Figura 1, que son:
- 2 mA (carga a 4.2 V, descarga a 3.9 V) x2, carga a 4.2 V
- 100 horas en circuito abierto, a partir de 4.2 V
El flujo de calor medido de la celda durante el ciclo tiene contribuciones de tres fuentes: entropía, polarización y calor parasítico de los electrodos positivo y negativo12. Las contribuciones de entropía y polarización son términos dependientes de la corriente, mientras que se cree que el calor parasítico es independiente de la corriente. Tanto el grafito como el LCO tienen grandes cambios de entropía durante la carga y la descarga (transiciones de etapas para el grafito13 y transiciones orden-desorden para LCO14), que son responsables de la mayor parte de la estructura reversible en el perfil de flujo de calor en la Figura 1a. Estas características se han analizado con más detalle en las Referencias 7 y 9. La polarización da como resultado un flujo de calor exotérmico mayoritariamente constante tanto en la carga como en la descarga. El resto de la señal es el resultado del flujo de calor parasítico.
Las celdas de bolsa hechas a máquina utilizadas en este experimento son nominalmente idénticas, ya que varían solo según la cantidad de VC agregada. La variación de capacidad entre celdas fue inferior al 1% en este caso. Con una corriente lo suficientemente pequeña, las contribuciones de la entropía y la polarización serán idénticas para todas las celdas, de modo que la única diferencia en el flujo de calor será el resultado de diferencias en el calor parasítico. La Figura 1a muestra que el flujo de calor de la celda que contiene 4% de VC es menor que el de la celda de control. Aunque no se muestra por claridad, todas las celdas que contienen VC tienen flujos de calor inferiores a los de la celda de control. La diferencia entre los flujos de calor cambia en función del estado de carga, lo que muestra la capacidad de la microcalorimetría isotérmica para determinar fácilmente la dependencia del voltaje de las reacciones parasíticas y dónde el VC u otros aditivos proporcionan su beneficio. En este ejemplo, al comparar el control con 4% de VC, el VC redujo notablemente el calor parasítico.
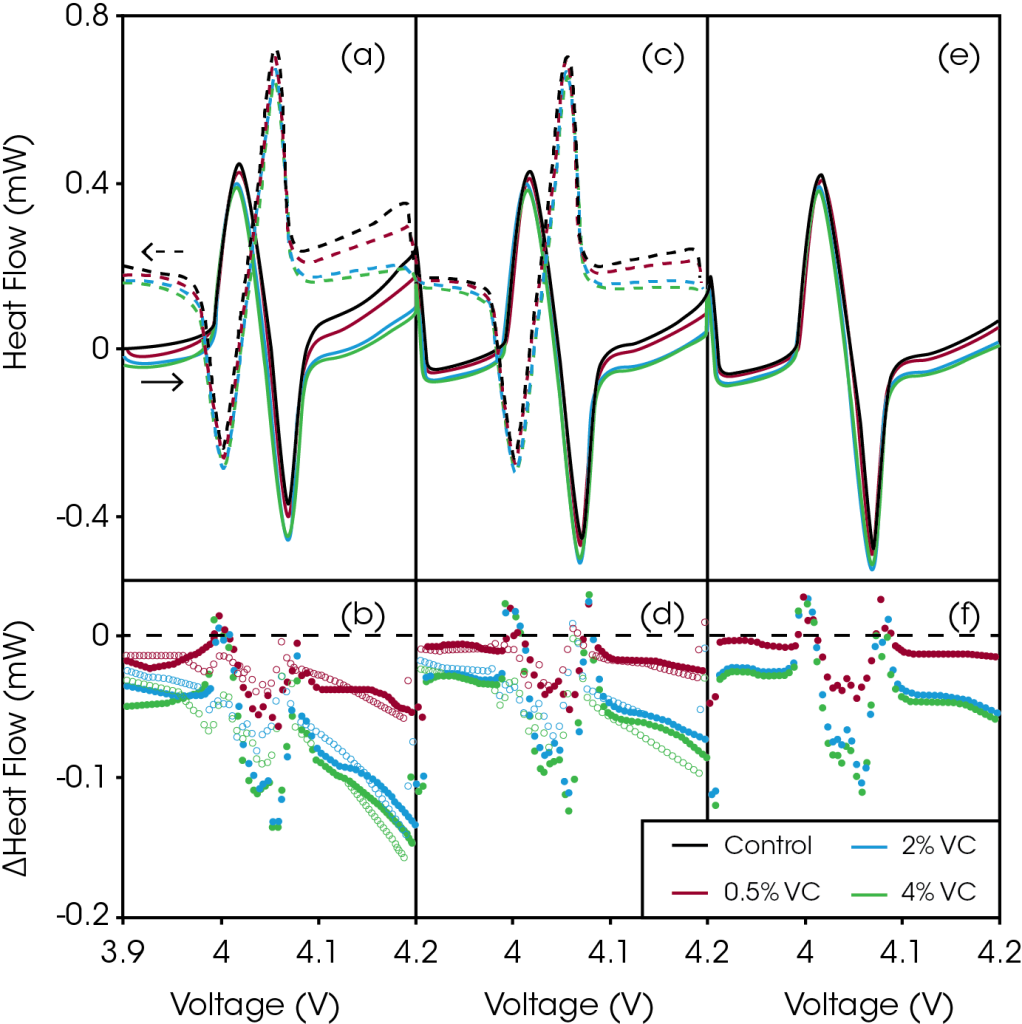
Tenga en cuenta que incluso para corrientes tan pequeñas, el flujo de calor generado desde las celdas de la bolsa fue de 2 a 3 órdenes de magnitud mayor que el nivel de ruido del microcalorímetro TAM, lo que permitió una diferenciación extremadamente precisa entre las celdas. La Figura 2 muestra el flujo de calor como una función del voltaje durante la región 1 del protocolo de ciclado descrito en la Figura 1 (3.9 – 4.2 V a 2 mA). La Figura 2a muestra el flujo de calor durante la primera carga y descarga de 2 mA para celdas con cantidades crecientes de VC. Al aumentar el voltaje, está claro que la adición de VC redujo el flujo de calor, dramáticamente en voltajes superiores a 4.1 V.
Figura 2. Los paneles (a), (c) y (e) muestran el flujo de calor en función del voltaje durante la carga (sólida) y la descarga (discontinua) de rango estrecho (3.9 – 4.2 V) de baja velocidad para el primer (a), segundo (c) y tercer (e) ciclos para control (negro), 0.5% VC (rojo), 2% VC (azul) y 4% VC (verde). Los paneles (b), (d) y (f) muestran la diferencia correspondiente en el flujo de calor como una función del voltaje entre las celdas que contienen VC y el control durante la carga (sólida) y la descarga (abierta) para el primer (b), segundo (d) y tercer (f) ciclos. Reproducido con autorización de ECS Electrochem Lett., 2, A106-A109 (2013). ©2013, The Electrochemical Society.
La Figura 2b muestra la diferencia obtenida al restar el flujo de calor de la celda de control (sin VC) del flujo de calor de las celdas que contienen VC como una función del voltaje. Esta diferencia es una buena medida de la reducción del calor parasítico debido al aditivo. En todo el rango de tensión se reduce el flujo de calor para las celdas que contienen VC. Sin embargo, de aproximadamente 3.98 a 4.1 V, esta diferencia se ve oscurecida por ligeras diferencias en la curvatura del perfil del flujo de calor al pasar por la transición orden-desorden en LCO. La reducción del flujo de calor es cada vez más pronunciada con un aumento de voltaje, lo que indica que VC está reduciendo las reacciones parasíticas que ocurren en el electrodo positivo. Aún 0.5% de VC produjo una disminución significativa en el flujo de calor de 54 μW a 4.2 V, mientras que 2% y 4% VC redujo el flujo de calor en 132 μW y 148 μW a 4.2 V, respectivamente. La reducción del calor parasítico como una función de la concentración de aditivo no es lineal. Las diferencias en el flujo de calor para las celdas que contienen 2% de VC y 4% de VC son muy similares, lo que implica que se obtiene poco beneficio al agregar más del 2% de VC en la química de esta celda.
Las figuras 2c y 2d muestran el flujo de calor como una función del voltaje y la gráfica de diferencia correspondiente para la segunda carga y descarga entre 3.9 y 4.2 V. El flujo de calor para las cuatro celdas en todos los voltajes se redujo ligeramente y las diferencias en el flujo de calor también se redujeron. Las figuras 2e y 2f muestran las mismas gráficas para la tercera y última carga. El flujo de calor y las diferencias en el flujo de calor se redujeron nuevamente. Las reacciones parasíticas disminuyeron al aumentar el número de ciclos, como era de esperar. Después de la tercera carga, la adición de 0.5%, 2% y 4% de VC reduce el flujo de calor parasítico a 4.2 V en 15 μW, 54 μW y 60 μW en comparación con la celda de control, respectivamente.
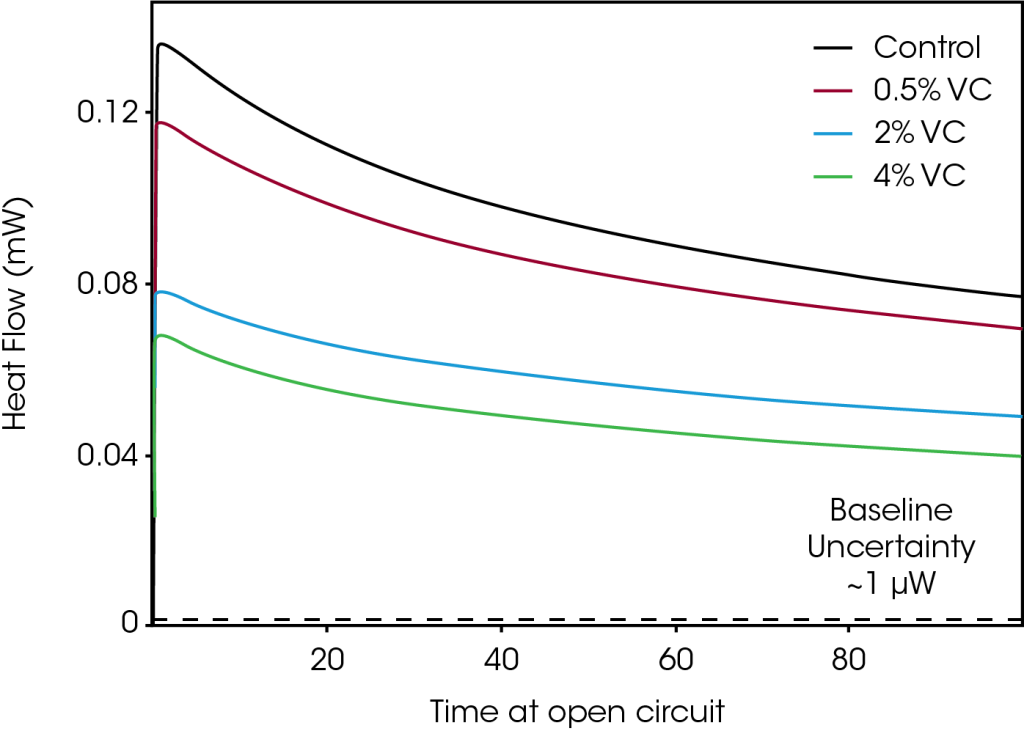
Flujo de calor en circuito abierto
La Figura 3 muestra la evolución del flujo de calor para el mismo conjunto de celdas tal como se dejaron en condiciones de circuito abierto después de cargarse a 4.2 V (paso 2 en la Figura 1). Dado que no se aplicó corriente a las celdas, las mediciones del flujo de calor en circuito abierto proporcionaron una medida directa del flujo de calor debido a reacciones parasíticas. Se observó una reducción pronunciada del calor parasítico con cantidades crecientes de VC, en concordancia cualitativa con los resultados mostrados en la Figura 2. La diferencia en el flujo de calor entre las celdas disminuye con el tiempo en el circuito abierto. Por ejemplo, después de 5 horas en circuito abierto, la diferencia en el flujo de calor entre el control y el 4% de VC es de 66 μW, mientras que después de 100 horas, esa diferencia disminuye a 31 μW. Esto concuerda con la reducción del calor parasítico con el aumento de los ciclos (y por lo tanto del tiempo) que se observa en la Figura 2.
CONCLUSIÓN
La microcalorimetría isotérmica es una técnica poderosa capaz de medir el rango de voltaje en el que cualquier aditivo o combinación de aditivos es más efectivo. Esto, a su vez, ayudará a comprender los aditivos de electrolitos y cómo elegir mejor una combinación de aditivos adecuada para una química de celda y una condición operativa en particular. Como demostración de la técnica, se examinó el efecto de diferentes concentraciones de VC en celdas completas de LCO/grafito. VC redujo drásticamente las reacciones parasíticas a altos potenciales, lo que sugiere que redujo las reacciones parasíticas que ocurren en el electrodo positivo.
REFERENCIAS
- L. E. Downie, K. J. Nelson, R. Petibon, V. L. Chevrier, and J. R. Dahn, ECS Electrochem. Lett., 2, A106–A109 (2013).
- W. Lu, I. Belharouak, D. Vissers, and K. Amine, J. Electrochem. Soc., 153, A2147–A2151 (2006).
- W. Lu, I. Belharouak, J. Liu, and K. Amine, J. Power Sources, 174, 673–677 (2007).
- W. Lu, I. Belharouak, J. Liu, and K. Amine, J. Electrochem. Soc., 154, A114–A118 (2007).
- W. Lu, I. Belharouak, S. H. Park, Y. K. Sun, and K. Amine, Electrochimica Acta, 52, 5837–5842 (2007).
- W. Lu and J. Prakash, J. Electrochem. Soc., 150, A262–A266 (2003).
- Y. Kobayashi, H. Miyashiro, K. Kumani, K. Takei, T. Iwahori, and I. Uchida, J. Electrochem. Soc., 149, A978–A982 (2002).
- J.-S. Kim, J. Prakash, and J. R. Selman, Electrochem. Solid-State Lett., 4, A141–A144 (2001).
- Y. Saito, K. Takano, K. Kanari, A. Negishi, K. Nozaki, and K. Kato, J. Power Sources, 97–98, 688–692 (2001).
- L. J. Krause, L. D. Jensen, and J. R. Dahn, J. Electrochem. Soc., 159, A937–A943 (2012).
- J. C. Burns, N. N. Sinha, D. J. Coyle, G. Jain, C. M. VanElzen, W. M. Lamanna, A. Xiao, E. Scott, J. P. Gardner, and J. R. Dahn, J. Electrochem. Soc., 159, A85–A90 (2012).
- J. R. Dahn, W.R. MacKinnon, J.J. Murray, R.R. Haering, R.S. McMillan, and A.H. Rivers-Bowerman, Phys. Rev. B, 32, 3316–3318 (1985).
- J. R. Dahn, Phys. Rev. B, 44, 9170–9177 (1991).
- J. N. Reimers and J. R. Dahn, J. Electrochem. Soc., 139, 2091–2097 (1992).
RECONOCIMIENTOS
Este trabajo fue contribuido por LE. Downie y coautores KJ Nelson, y J.R. Dahn del Departamento de Física y Ciencias Atmosféricas de la Universidad de Dalhousie, Halifax, NS, B3H 4R2, Canadá, como parte del Programa de Premios de Solicitudes Estudiantiles de TA Instruments. Los autores agradecen el apoyo de este trabajo bajo los auspicios de la Cátedra de Investigación Industrial NSERC/3M Canadá en Materiales para Baterías Avanzadas. LED y KJN reconocen el apoyo financiero del programa NSERC CREATE DREAMS de la Universidad de Dalhousie. Los autores agradecen al Dr. Jing Li de BASF por proporcionar los disolventes y las sales de electrolitos. Se agradecen las conversaciones útiles con el Dr. Larry Krause de 3M.
The authors acknowledge the support of this work under the auspices of the NSERC/3M Canada Industrial Research Chair in Materials for Advanced Batteries. LED and KJN acknowledge financial support from the NSERC CREATE DREAMS program at Dalhousie University. The authors thank Dr. Jing Li of BASF for providing the electrolyte solvents and salts. Useful discussions with Dr. Larry Krause at 3M are acknowledged.
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

