Optimisation des réactions catalytiques par l’ATG à haute pression
Frieder Dreisbach
March 28, 2022
Les réactions catalytiques sont présentes partout : des plastiques et du pain à plus de 90% des produits chimiques dans le monde, un nombre incalculable de biens et de matériaux sont fabriqués à l’aide de catalyseurs.1 Les catalyseurs sont des substances capables d’accélérer les réactions chimiques lentes. Les réactions plus rapides sont plus compétitives du point de vue technologique et économique. En outre, les catalyseurs optimisés offrent un énorme potentiel de réduction des consommations d’énergie, de ressources et de limitation des émissions de dioxyde de carbone.
Catalyse hétérogène
Dans les applications industrielles, la catalyse, ou une réaction utilisant un catalyseur, est classée soit comme , où le catalyseur est dans la même phase (généralement liquide) que le réactif, soit comme hétérogène, où souvent un catalyseur solide réagit avec des réactifs fluides (gazeux ou liquides).
La catalyse hétérogène est un processus d’interface, c’est-à-dire que la taille de la surface accessible du catalyseur influence la vitesse de réaction. La majorité des matériaux catalytiquement actifs est constituée de petites particules présentant un rapport surface/masse élevé, permettant une plus grande réactivité avec moins de catalyseur.
Les chercheurs évaluent les taux de réaction dans des conditions d’application en vue d’optimiser leur procédé et de tirer le meilleur parti des matériaux catalytiques coûteux. Grâce à des matériaux catalytiques plus performants, les réactions ont besoin de moins de catalyseur et coûtent donc moins cher, tout en réduisant la consommation énergétique et en exigeant moins de ressources naturelles pour la fabrication des produits.
Test de catalyseur par ATG à haute pression
L’analyse thermogravimétrique à haute pression (ATG-HP) donne aux chercheurs la possibilité d’étudier les réactions entre un catalyseur et un réactif en phase gazeuse dans des conditions de travail réalistes à l’échelle du laboratoire. Les conditions de réaction sont notamment la haute pression, la haute température, les mélanges de gaz réactifs et la vapeur. L’activation et la désactivation d’un catalyseur par oxydation, réduction ou cokéfaction sont associées à un changement de masse et sont mesurables avec une haute résolution en ATG-HP. Simultanément, le rendement et la cinétique de la réaction pourront être suivis par l’analyse des gaz émis avec la spectrométrie de masse en ligne, la chromatographie en phase gazeuse, l’IRTF ou d’autres méthodes. Ces données sont extrêmement utiles pour l’optimisation des conditions de réaction et le développement de matériaux catalytiques plus performants.
L’instrument ATG HP peut servir de réacteur catalytique tout en surveillant la masse du catalyseur. Ce dispositif expérimental permet aux chercheurs d’identifier très précisément les conditions qui induisent les réactions catalytiques et les modifications du matériau catalytique comme l’activation ou la désactivation. L’atmosphère réactionnelle de l’ATG HP peut être constituée de gaz réactifs courants comme l’hydrogène, le méthane, l’éthane, le dioxyde de carbone ou le monoxyde de carbone, mais aussi de vapeur, et les conditions expérimentales peuvent couvrir des températures pouvant aller jusqu’à 1100°C et des pressions pouvant atteindre 80 bars.
Le principal avantage de la réalisation de réactions catalytiques en phase gazeuse sur des catalyseurs solides dans un instrument ATG est de mesurer la masse du catalyseur au cours de l’expérience afin de détecter continuellement et quantitativement les processus d’activation ou de désactivation du catalyseur au moment où ils se produisent.
Optimiser le rendement et la productivité
Un des éléments clés de l’amélioration de l’efficacité des réactions catalytiques est le choix des conditions de fonctionnement optimales pour une réaction donnée. Les coûts des produits et l’empreinte environnementale peuvent être encore réduits en développant des procédés catalytiques utilisant des matières premières alternatives, qui requièrent également un contrôle adapté du processus.2
Exemple d’optimisation des conditions de catalyse: La méthanation du dioxyde de carbone est un procédé qui permet de générer du méthane par réduction avec de l’hydrogène suivant l’équation de réaction CO2 + 4 H2 ↔ CH4 + 2 H20. L’hydrogène issu de l’énergie renouvelable peut servir à convertir le dioxyde de carbone en méthane vert utilisé comme matière première pour le traitement chimique. Cette réaction présente un grand intérêt commercial comme procédé clé dans le concept de conversion de l’énergie en gaz (PtG). Dans l’exemple illustré ici, un catalyseur au nickel sur support d’alumine est utilisé pour la réaction de méthanation dans une série d’expériences catalytiques avec un mélange gazeux de 2 % de CO2, 8 % de H2 et 90 % d’Ar. La dépendance à la pression et à la température du rendement de la réaction a été vérifiée à différentes températures entre 275°C et 350°C et à 1,5 bar, 15 bar et 30 bar grâce à un SM en ligne. La figure 2 compare le rendement en méthane aux trois pressions en suivant le rapport masse/charge m/z 15, correspondant à la concentration de méthane qui est le produit cible de la réaction de méthanation.
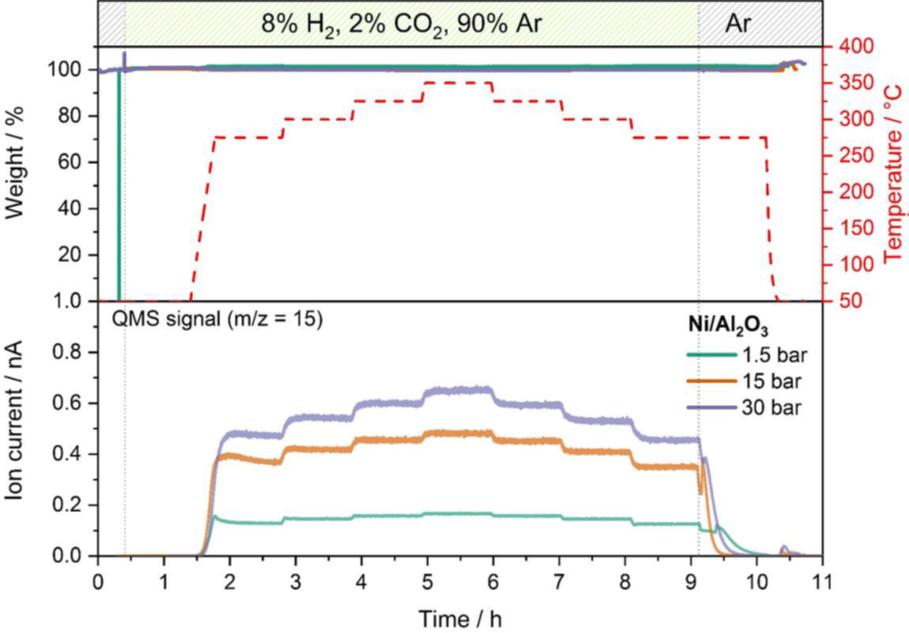
La comparaison des données MS à des pressions et températures diverses révèle qu’une pression plus élevée conduit à un rendement de réaction plus important. L’influence de la température sur le rendement est identique, mais plus prononcée à 15 et 30 bars en comparaison avec la mesure à 1,5 bar. Aucun changement de masse du catalyseur n’a été détecté à aucune pression, ce qui montre qu’aucune désactivation ou réaction secondaire ne s’est produite.
Désactivation du catalyseur
La désactivation du catalyseur décrit la perte d’activité ou de sélectivité catalytique au fil du temps. Tous les catalyseurs se désactivent avec le temps et nécessitent d’être remplacés, mais la durée de fonctionnement avant désactivation est très variable : elle dépend, entre autres, du type de catalyseur, du procédé et du maintien de conditions de fonctionnement optimales. Les catalyseurs peuvent se désactiver en quelques secondes ou fonctionner comme prévu pendant plusieurs années.3 Pour les procédés catalytiques industriels, la désactivation du catalyseur constitue un risque économique majeur. L’arrêt des processus et le remplacement des catalyseurs représentent des milliards de dollars par an pour l’industrie chimique.4
La désactivation des catalyseurs est due à des mécanismes chimiques, mécaniques et thermiques communs qui peuvent être classés en différents types : contamination, cokéfaction ou encrassement et vieillissement.5, 6
Bien que la désactivation du catalyseur soit le plus souvent inévitable à long terme, le début d’une désactivation prématurée peut généralement être empêché par des mesures adéquates de contrôle du processus7, qui font l’objet de recherches et de développement dans le but de concevoir des processus industriels et des matériaux catalytiques plus robustes8.
Évaluation de la cokéfaction des catalyseurs
La désactivation du catalyseur en raison de la formation de coke est un problème technologique et économique majeur dans le raffinage du pétrole et l’industrie pétrochimique. Une meilleure résistance des catalyseurs à la cokéfaction est possible en utilisant d’autres métaux catalytiquement actifs et/ou en ajustant les conditions de réaction telles que la température, la pression ou la composition du gaz. L’optimisation des matériaux et des procédés pour la formation de coke requiert de mesurer la cinétique de désactivation du catalyseur dans des conditions de réaction réelles.9
Exemple de mesure de la cokéfaction : Une réaction de reformage à la vapeur à 700°C et 10 bars est présentée ci-dessous. L’atmosphère de réaction est constituée d’argon, de méthane et de vapeur, avec un rapport vapeur/méthane de 4:1. Dans de telles conditions, la production d’hydrogène est détectée par le MS en ligne tandis que la masse du catalyseur reste constante. Pour évaluer le début de la cokéfaction, le rapport vapeur/méthane est modifié à 1:1, puis à 1:2 par ajustement des débits de méthane et de vapeur. La figure 3 visualise la masse du catalyseur et le rapport vapeur/méthane au fil du temps.
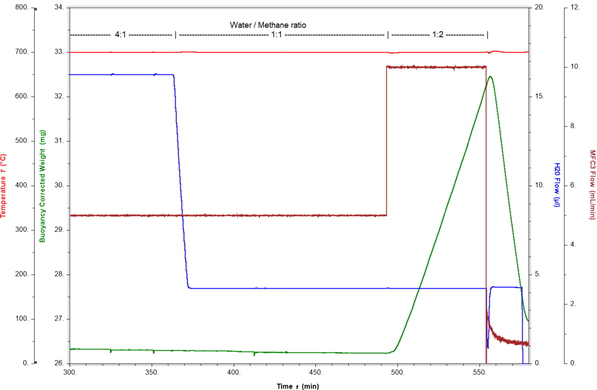
Pour des rapports vapeur/méthane de 4:1 et 1:1, la masse du catalyseur est stable. Lorsque le rapport est modifié à 1:2, l’excès de méthane entraîne une augmentation immédiate et rapide de la masse de 0,3 %/min. Cette augmentation de masse est provoquée par la formation de coke (carbone élémentaire) sur le catalyseur. Ce processus de cokéfaction peut être inversé, et le catalyseur régénéré en coupant le flux de méthane. La vapeur d’eau oxyde le coke, ce qui entraîne une perte de masse rapide de 0,9 %/min. En seulement 15 minutes, plus de 4 mg de coke sont éliminés de la surface du catalyseur. Cela prouve la réversibilité du processus si les conditions de réaction sont ajustées assez rapidement. La figure 4 montre que la cokéfaction peut conduire à la formation de quantités impressionnantes de carbone si les conditions de réaction ne sont pas très vite modifiées après le début de la formation de coke.

La catalyse optimisée n’est qu’une expérience de plus
Comme le démontrent les exemples et les techniques ci-dessus, il est possible d’améliorer la catalyse en sélectionnant le meilleur catalyseur et les meilleurs réactifs, en optimisant les conditions de réaction et en évitant, retardant ou inversant la désactivation. Les réactions catalytiques optimisées offrent une durabilité croissante tout en réduisant les coûts.
L’ATG haute pression est une méthode de pointe permettant d’étudier la performance des catalyseurs et d’optimiser les réactions catalytiques hétérogènes. Les réactions en phase gazeuse telles que la méthanation, le reformage à la vapeur et de nombreuses autres réactions importantes sur le plan technique et commercial peuvent être réalisées dans un instrument d’ATG HP dans des conditions pertinentes de pression, de température et de composition des gaz ou de vapeur. Le renouvellement de la réaction peut être suivi par analyse EGA avec spectrométrie de masse, FTIR ou autres méthodes adéquates et le signal de masse du catalyseur fournit de précieuses données en temps réel sur les processus d’activation et de désactivation.
Voulez-vous en savoir plus sur le potentiel de l’ATG dans l’optimisation des matériaux et des processus catalytiques ? Veuillez consulter notre note d’application sur le sujet ou regarder les webinaires enregistrés sur L’ATG dans des conditions extrêmes ou l’optimisation des catalyseurs à l’aide des méthodes d’ATG. N’hésitez pas à contacter les experts de TA Instruments pour discuter de vos besoins de test et découvrir l’instrumentation idéale pour votre laboratoire.
Références:
- Ma, Z. and Zaera, F., Heterogeneous Catalysis by Metals, in King, R. Bruce; Crabtree, Robert H.; Lukehart, Charles M.; Atwood, David A. (eds.), Encyclopedia of Inorganic Chemistry, John Wiley & Sons, Ltd.
- Anderson, N., (2000), Practical Process Research & Development, Optimizing Catalytic Reactions, 185-201.
- Bartholomew, C.H., Mechanisms of catalyst deactivation, Applied Catalysis A: General 212 (2001) 17–60.
- Boskovic G., Baerns M. (2004), Catalyst Deactivation, in: Baerns M. (eds) Basic Principles in Applied Catalysis. Springer Series in Chemical Physics, vol 75. Springer, Berlin, Heidelberg.
- Figuerido, J.L. (Ed.), Progress in Catalyst Deactivation, NATO Advanced Study Institute Series E, Marunus Nijhoff, Boston, 1982.
- Hughes, R., Deactivation of Catalysts, Academic Press, London, 1984 (Chapter 8).
- Oudar, J. and Wise, H., Deactivation and Poisoning of Catalysts, Marcel Dekker, New York, 1985, 1.
- Butt, J.B., Petersen, E.E., Activation, Deactivation, and Poisoning of Catalysts, Academic Press, San Diego, 1988.
- Wolf, E. E. and Alfani, F., (1982), Catalysts Deactivation by Coking, Catalysis Reviews, 24:3, 329-371

