Mots clés : calorimétrie isotherme, TAM, flux de chaleur, batteries lithium-ion, additifs d’électrolyte, chaleur parasite
MC162-FR
RÉSUMÉ
La microcalorimétrie isotherme est une méthode simple de détermination de l’effet d’un additif d’électrolyte ou d’une combinaison d’additifs d’électrolyte sur les réactions parasites qui surviennent dans une batterie lithium-ion, en fonction de l’état de charge de la batterie. Dans cette étude, un microcalorimètre TAM à haute résolution équipé de 12 microcalorimètres a été utilisé pour mesurer et comparer de manière quantitative le flux de chaleur de batteries lithium-ion dont le seul paramètre variable est la concentration de l’additif d’électrolyte. Dans ce cas, toutes les autres sources étant identiques, la différence mesurée du flux de chaleur est la conséquence directe de la différence de chaleur parasite due à l’additif. Elle est exprimée en fonction de l’état de charge, ce qui constitue une méthode simple et rapide de détermination exacte du moment où l’additif d’électrolyte réduit les réactions parasites et du degré de réduction de ces réactions par l’additif. À titre d’exemple, l’effet de plusieurs concentrations de carbonate de vinylène (VC) sur une cellule de LiCoO2/graphite est examiné. Il est démontré que la présence de VC réduit les réactions parasites au-dessus de 3,9 V et continue de réduire ces réactions lorsque l’état de charge augmente. La méthode et les données présentées ici ont été publiées (Référence 1) et leur reproduction a été autorisée. ©2013, The Electrochemical Society.
Introduction
Les batteries lithium-ion sont utilisées dans un nombre croissant d’applications qui exigent de plus hautes densités d’énergie et de plus longues durées de vie. L’utilisation d’additifs d’électrolyte est une méthode courante qui s’est avérée prolonger la vie calendaire et le cycle de vie, et réduire les réactions parasites qui ont lieu entre l’électrolyte et les matériaux des électrodes. Cependant, le fonctionnement de ces additifs et le moment exact du cycle de charge-décharge où ces additifs s’avèrent bénéfiques sont mal compris. Il est par conséquent particulièrement intéressant de déterminer le bénéfice d’un additif ou d’une combinaison d’additifs spécifique en fonction de la tension de la batterie, afin de mieux comprendre comment ces additifs prolongent la durée de vie des batteries lithium-ion.
La technique de microcalorimétrie isotherme a récemment été couplée à des mesures électrochimiques dans le but d’examiner le comportement thermique de plusieurs chimies lithium-ion2-9. Plus récemment, Krause et coll.10 ont démontré comment utiliser cette technique pour dissocier les diverses contributions à la puissance thermique et isoler l’énergie parasite. Cette technique est utilisée ici pour comparer de manières qualitative et quantitative le flux de chaleur entre des cellules dont le seul paramètre variable est la concentration de l’additif. Dans ce cas, toutes les autres sources étant identiques, la différence mesurée du flux de chaleur résulte des différences de chaleur parasite. Elle est exprimée en fonction de l’état de charge, ce qui constitue une méthode simple et rapide de détermination exacte du moment où l’additif réduit les réactions parasites qui se produisent entre l’électrolyte et les matériaux des électrodes, et du degré de réduction de ces réactions par l’additif. À titre d’exemple, l’effet de plusieurs concentrations de carbonate de vinylène (VC) sur une cellule de LiCoO2/graphite est examiné, le VC étant un additif d’électrolyte largement utilisé qui s’est avéré prolonger la durée de vie des cellules11.
DONNÉES EXPÉRIMENTALES
Des cellules « pochette » LiCoO2 (LCO)/graphite 225 mAh fabriquées mécaniquement (obtenues auprès de Pred Materials Co.) ont été fournies sèches. Les pochettes contenaient 0,75 g d’électrolyte constitué de LiPF6 1M dans un mélange carbonate d’éthylène : carbonate d’éthyle méthyle de ratio 3:7 (Novolyte Technologies, désormais BASF) avec diverses quantités d’additif VC (Novolyte Technologies, désormais BASF) (0 % ; 0,5 % ; 2 % ; et 4 % en poids) conditionné sous vide. Le mouillage des électrodes a été réalisé par centrifugation à une accélération de 50G pendant 20 minutes. Les cellules ont ensuite été formées ; elles ont été maintenues à 1,5 V pendant 24 heures à 40 °C, puis chargées à 2 mA pendant 10 heures, et puis chargées à 15 mA jusqu’à 4,2 V, et enfin déchargées à 15 mA jusqu’à 3,775 V. Les cellules ont alors été ouvertes pour libération des gaz éventuels, puis reconditionnées. La charge et la décharge des cellules à l’intérieur du microcalorimètre ont été effectuées avec un système de test automatisé Maccor series 4000 (Maccor Inc.).
Les mesures du flux de chaleur par microcalorimétrie isotherme ont été effectuées avec un calorimètre TAM (TA Instruments-Waters LLC), selon une incertitude de mesure < ±1,0 μW, à la température de 40,0 °C. Les spécificités de l’étalonnage et du fonctionnement de l’instrument, les informations contextuelles et les méthodes sont présentées en détail dans la Référence 10. Le niveau de bruit de l’instrument est d’environ 10 nW et la dérive de la ligne de base était inférieure à 500 nW sur la période pendant laquelle les expérimentations ont été réalisées. [/vc_column_text][/vc_column][/vc_row][vc_row][vc_column][vc_column_text]
RÉSULTATS ET DISCUSSION
Flux de chaleur au cours du cyclage
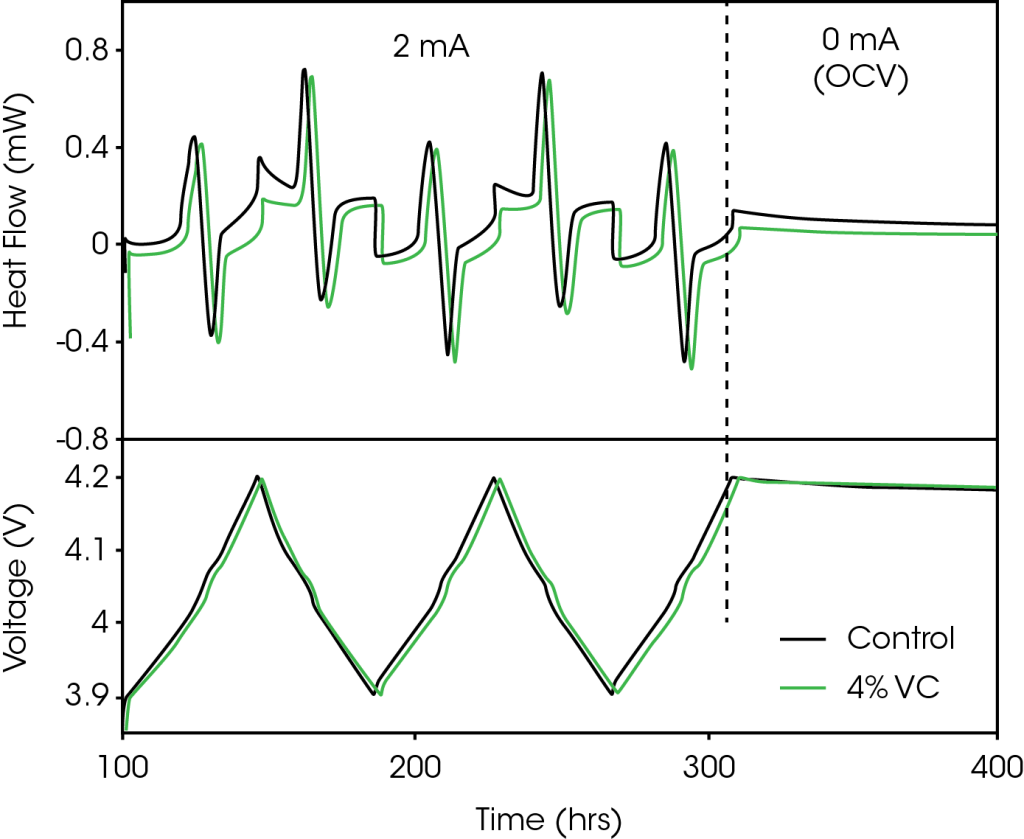
La Figure 1 illustre un segment représentatif du protocole de cyclage utilisé pour les cellules testées à l’intérieur du microcalorimètre. La Figure 1a représente le flux de chaleur mesuré et la Figure 1b illustre le profil de tension correspondant. Par souci de simplicité, seules les données de la cellule de contrôle (sans VC) et celles de la cellule contenant 4 % de VC sont présentées. Le protocole de cyclage présente deux segments distincts, comme le montre la ligne en pointillé verticale de la Figure 1, qui sont les suivants :
- 2 mA (charge jusqu’à 4,2 V, décharge jusqu’à 3,9 V) x2, charge jusqu’à 4,2 V
- 100 heures en circuit ouvert, en démarrant à 4,2 V
Le flux de chaleur de la cellule mesuré pendant le cyclage est généré par trois sources : l’entropie, la polarisation et la chaleur parasite des électrodes positive et négative12. Les contributions de l’entropie et de la polarisation sont dépendantes du courant, tandis que la contribution de la chaleur parasite serait indépendante du courant. Le graphite et le LCO présentent des variations importantes d’entropie pendant la charge et la décharge (transitions d’état pour le graphite13 et transitions ordre-désordre pour le LCO14), qui sont responsables de la majorité de la structure réversible du profil du flux de chaleur illustré à la Figure 1a. Ces aspects ont été abordés plus en détail dans les Références 7 et 9. La polarisation occasionne un flux de chaleur exothermique quasi constant tout au long de la charge et de la décharge. La partie restante du signal résulte du flux de chaleur parasite.
Les cellules « pochette » fabriquées mécaniquement qui sont utilisées dans cette expérimentation ont toutes les mêmes caractéristiques nominales. Le seul paramètre variable est la quantité de VC ajoutée. La variation intercellules de la capacité est ici inférieure à 1 %. Si le courant est suffisamment faible, les contributions de l’entropie et de la polarisation sont les mêmes pour toutes les cellules, de sorte que la seule différence de flux de chaleur résulte des différences de chaleur parasite. La Figure 1a montre que le flux de chaleur de la cellule contenant 4 % de VC est inférieur à celui de la cellule de contrôle. Bien que cela ne soit pas illustré pour des raisons de clarté, toutes les cellules contenant du VC présentent des flux de chaleur inférieurs à celui de la cellule de contrôle. La différence entre les flux de chaleur varie en fonction de l’état de charge, montrant la capacité de la microcalorimétrie isotherme à déterminer facilement la dépendance à la tension des réactions parasites, et le moment où le VC ou les autres additifs sont bénéfiques. Dans cet exemple comparant la cellule de contrôle à une cellule contenant 4 % de VC, le VC a réduit la chaleur parasite de manière significative.
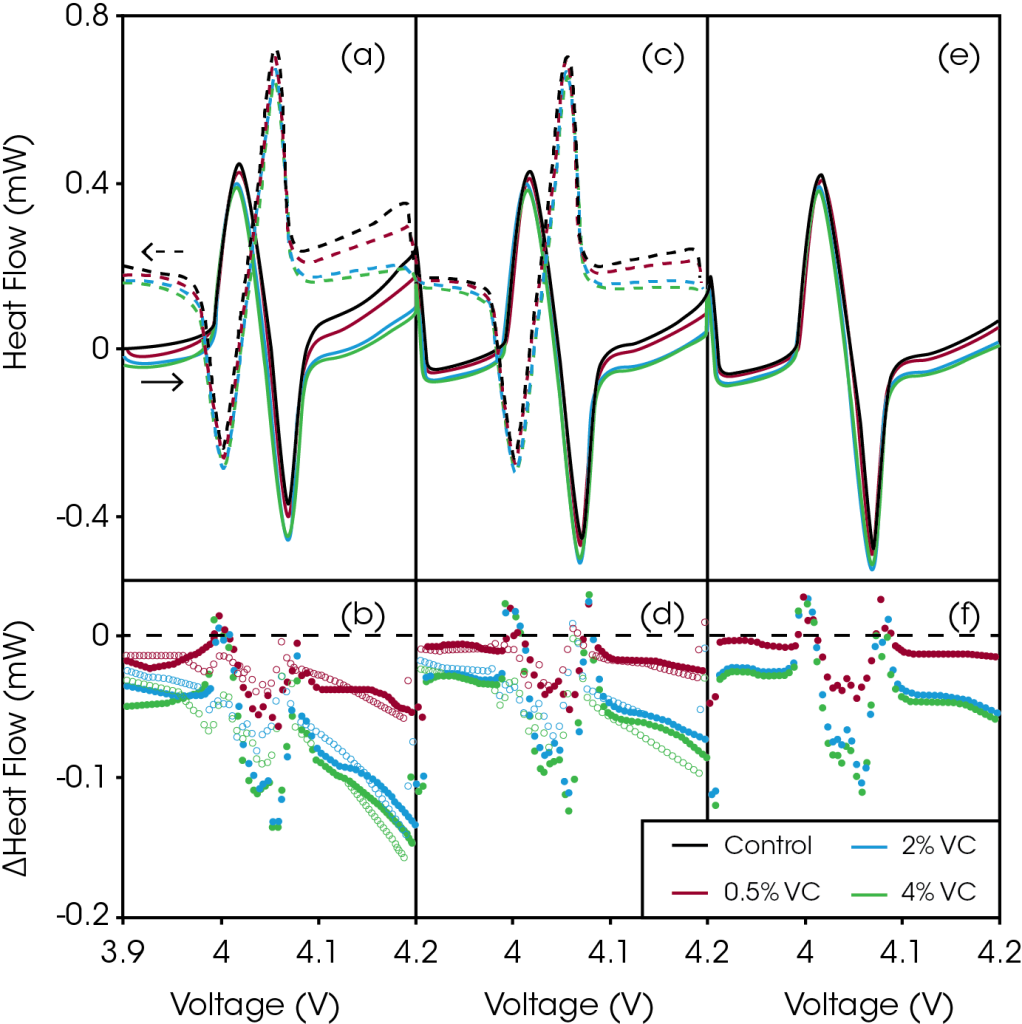
Notez que même pour ces faibles courants, le flux de chaleur émis par les cellules « pochette » était supérieur au niveau de bruit du microcalorimètre TAM de 2 à 3 ordres de grandeur, ce qui permet une différenciation très précise des cellules. La Figure 2 représente le flux de chaleur en fonction de la tension au cours de la région 1 du protocole de cyclage illustré à la Figure 1 (3,9 – 4,2 V à 2 mA). La Figure 2a illustre le flux de chaleur pendant la première charge-décharge à 2 mA pour des cellules dont la quantité de VC croît. Lorsque la tension augmente, il apparaît clairement que l’ajout de VC a réduit le flux de chaleur, de manière spectaculaire aux tensions supérieures à 4,1 V.
Figure 2. Les volets (a), (c) et (e) présentent le flux de chaleur en fonction de la tension pendant la charge (lignes pleines) et la décharge (lignes en pointillé) à taux faible, à plage de tension étroite (3,9 – 4,2 V), pour les premier (a), deuxième (c) et troisième (e) cycles, pour les cellules suivantes : contrôle (en noir), 0,5 % de VC (en rouge), 2 % de VC (en bleu) et 4 % de VC (en vert). Les volets (b), (d) et (f) représentent la différence de flux de chaleur correspondante en fonction de la tension, entre les cellules contenant du VC et la cellule de contrôle, pendant la charge (points pleins) et la décharge (points vides) pour les premier (b), deuxième (d) et troisième (f) cycles. Reproduction avec l’autorisation d’ECS Electrochem Lett., 2, A106-A109 (2013). ©2013, The Electrochemical Society.
La Figure 2b montre la différence obtenue en soustrayant le flux de chaleur de la cellule de contrôle (sans VC) au flux de chaleur des cellules contenant du VC, en fonction de la tension. Cette différence est une mesure valable de la réduction de la chaleur parasite due à l’additif. Sur toute la plage de tension, le flux de chaleur des cellules contenant du VC est réduit. Toutefois, entre environ 3,98 et 4,1 V, cette différence est masquée par de légères différences de courbure du profil du flux de chaleur survenant lors de la transition ordre-désordre du LCO. La réduction du flux de chaleur est de plus en plus marquée au fur et à mesure que la tension augmente, indiquant que le VC réduit les réactions parasites qui se produisent à l’électrode positive. Même 0,5 % de VC a produit une réduction significative du flux de chaleur de 54 μW à 4,2 V, tandis que 2 % et 4 % de VC ont réduit le flux de chaleur de 132 μW et 148 μW à 4,2 V, respectivement. La réduction de la chaleur parasite en fonction de la concentration d’additif est non linéaire. Les différences de flux de chaleur pour les cellules contenant 2 % de VC et 4 % de VC sont très similaires, indiquant le faible bénéfice d’ajouter plus de 2 % de VC dans cette chimie de cellule.
Les Figures 2c et 2d représentent le flux de chaleur en fonction de la tension, et le graphique de différence correspondant pour la deuxième charge-décharge entre 3,9 et 4,2 V. Le flux de chaleur pour les quatre cellules, à toutes les tensions, était légèrement réduit, et les différences de flux de chaleur étaient également réduites. Les Figures 2e et 2f montrent les mêmes graphiques pour la troisième et dernière charge. Le flux de chaleur et les différences de flux de chaleur étaient à nouveau réduits. Les réactions parasites ont diminué au fur et à mesure que le nombre de cycles augmentait, comme anticipé. Après la troisième charge, l’ajout de 0,5 %, 2 % et 4 % de VC réduit le flux de chaleur parasite à 4,2 V de 15 μW, 54 μW et 60 μW par rapport à la cellule de contrôle, respectivement.
Flux de chaleur en circuit ouvert
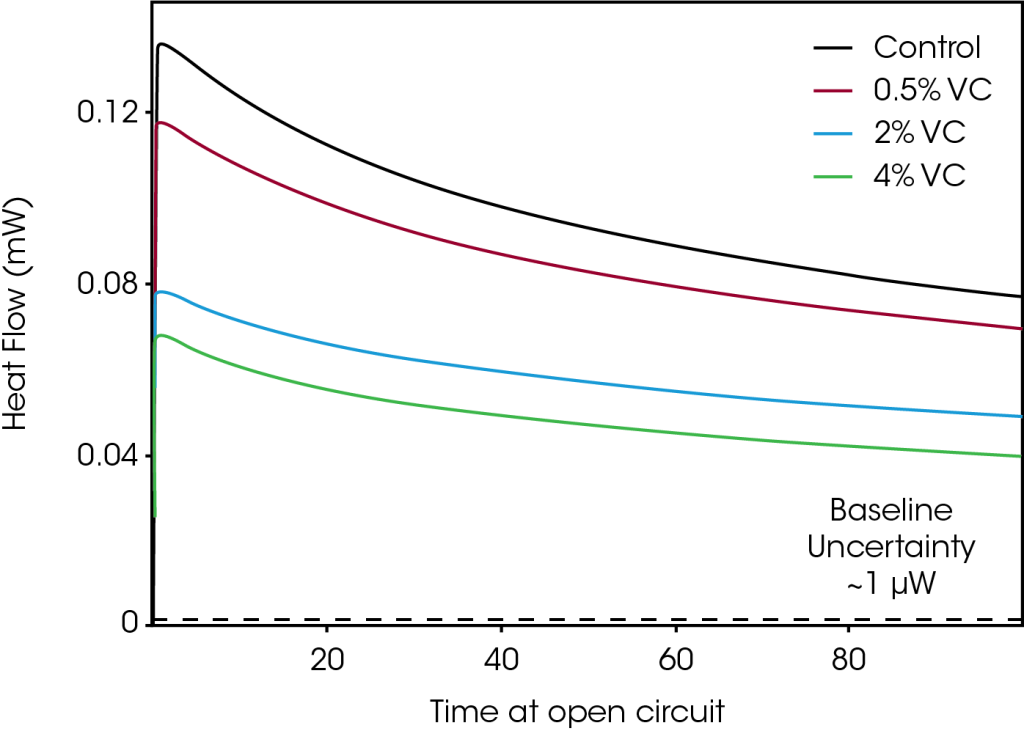
La Figure 3 représente l’évolution du flux de chaleur pour le même ensemble de cellules, lorsque les cellules ont été mises en circuit ouvert après avoir été chargées à 4,2 V (étape 2 de la Figure 1). Aucun courant n’étant appliqué aux cellules, les mesures du flux de chaleur en circuit ouvert représentaient une mesure directe du flux de chaleur dû aux réactions parasites. Une réduction marquée de la chaleur parasite a été observée au fur et à mesure que la quantité de VC augmentait, ce qui montre une concordance qualitative avec les résultats illustrés à la Figure 2. La différence de flux de chaleur entre les cellules diminue avec le temps en circuit ouvert. Par exemple, après 5 heures en circuit ouvert, la différence de flux de chaleur entre la cellule de contrôle et la cellule à 4 % de VC est de 66 μW, alors qu’après 100 heures, cette différence diminue de 31 μW. Cette observation est cohérente avec la réduction de la chaleur parasite au fur et à mesure que le nombre de cycles augmente (et par conséquent que le temps s’écoule), qui a été constatée à la Figure 2.
Conclusions
La microcalorimétrie isotherme est une puissante technique qui permet de mesurer la plage de tension sur laquelle un additif ou une combinaison d’additifs quelconque est d’efficacité maximale. Cela participe aux efforts destinés à comprendre les additifs d’électrolyte et à savoir choisir la meilleure combinaison d’additifs pour une chimie de cellule et des conditions de fonctionnement spécifiques. Pour illustrer la technique, l’effet de différentes concentrations de VC sur les cellules entières LCO/graphite a été étudié. Le VC a considérablement réduit les réactions parasites lorsque les potentiels sont élevés, suggérant qu’il a réduit les réactions parasites à l’électrode positive.
RÉFÉRENCES
- L. E. Downie, K. J. Nelson, R. Petibon, V. L. Chevrier, and J. R. Dahn, ECS Electrochem. Lett., 2, A106–A109 (2013).
- W. Lu, I. Belharouak, D. Vissers, and K. Amine, J. Electrochem. Soc., 153, A2147–A2151 (2006).
- W. Lu, I. Belharouak, J. Liu, and K. Amine, J. Power Sources, 174, 673–677 (2007).
- W. Lu, I. Belharouak, J. Liu, and K. Amine, J. Electrochem. Soc., 154, A114–A118 (2007).
- W. Lu, I. Belharouak, S. H. Park, Y. K. Sun, and K. Amine, Electrochimica Acta, 52, 5837–5842 (2007).
- W. Lu and J. Prakash, J. Electrochem. Soc., 150, A262–A266 (2003).
- Y. Kobayashi, H. Miyashiro, K. Kumani, K. Takei, T. Iwahori, and I. Uchida, J. Electrochem. Soc., 149, A978–A982 (2002).
- J.-S. Kim, J. Prakash, and J. R. Selman, Electrochem. Solid-State Lett., 4, A141–A144 (2001).
- Y. Saito, K. Takano, K. Kanari, A. Negishi, K. Nozaki, and K. Kato, J. Power Sources, 97–98, 688–692 (2001).
- L. J. Krause, L. D. Jensen, and J. R. Dahn, J. Electrochem. Soc., 159, A937–A943 (2012).
- J. C. Burns, N. N. Sinha, D. J. Coyle, G. Jain, C. M. VanElzen, W. M. Lamanna, A. Xiao, E. Scott, J. P. Gardner, and J. R. Dahn, J. Electrochem. Soc., 159, A85–A90 (2012).
- J. R. Dahn, W.R. MacKinnon, J.J. Murray, R.R. Haering, R.S. McMillan, and A.H. Rivers-Bowerman, Phys. Rev. B, 32, 3316–3318 (1985).
- J. R. Dahn, Phys. Rev. B, 44, 9170–9177 (1991).
- J. N. Reimers and J. R. Dahn, J. Electrochem. Soc., 139, 2091–2097 (1992).
REMERCIEMENTS
Ces travaux ont été réalisés par L.E. Downie et les coauteurs K.J. Nelson et J.R. Dahn du Département de physique et de science atmosphérique, Université de Dalhousie, Halifax, N.S., B3H 4R2, Canada, dans le cadre du programme de récompenses des candidatures d’étudiants TA Instruments. Les auteurs remercient le Chaire de recherche industrielle CRSNG/3M Canada sur les matériaux pour systèmes d’accumulateurs perfectionnés pour son soutien à ces travaux. LED et KJN remercient le programme CREATE DREAMS du CRSNG de l’Université de Dalhousie pour son soutien financier. Les auteurs remercient le Dr Jing Li du BASF de leur avoir fourni des solvants et sels d’électrolyte. Ils remercient également le Dr Larry Krause de chez 3M pour les discussions utiles.
Cliquez ici pour télécharger la version imprimable de cette note d’application.

