Mots clés : microcalorimétrie, électrochimique, chaleur, batterie, lithium-ion, primaire, secondaire, autodécharge, réaction parasite
MC158-FR
GÉNÉRALITÉS
L’énergie électrique alimente nos vies, car elle est facile à convertir en chaleur, lumière, liaisons chimiques ou travail mécanique lorsque nécessaire. De plus en plus d’applications requièrent de l’électricité hors réseau, comme les téléphones portables, les véhicules et divers équipements ménagers. Nombre de ces appareils nécessitent de grandes quantités d’énergie stockée dans des espaces réduits. Ceci a conduit à une forte innovation et à un développement important en matière de technologies de batterie, avec une priorité donnée à l’augmentation du nombre de cycles de charge des cellules rechargeables, à l’allongement de la durée de vie utile et au renforcement de la sécurité. Il n’est pas exagéré d’affirmer que la batterie lithium-ion dans ses diverses chimies et formes est essentielle au développement de véhicules électriques et de nombreux appareils portables. D’ailleurs, les inventeurs de la cellule lithium-ion ont reçu le prix Nobel de chimie 2019 pour « avoir créé un monde rechargeable ». Différentes chimies de cellule sont en cours d’étude tandis que les cellules lithium-ion monopolisent actuellement les activités de R&D et dominent sur le marché des batteries rechargeables.
Les processus électrochimiques qui se déroulent dans les batteries, que ce soit dans des conditions de fonctionnement ou de charge, provoquent un échange de chaleur avec l’environnement. Le travail effectué lorsque les espèces chargées circulent à l’intérieur d’une cellule génère de la chaleur et entraîne les processus redox à l’anode et à la cathode et diverses réactions secondaires parasites responsables de la limitation de la durée de vie d’une batterie.
Les processus qui provoquent des changements de matière sont généralement accompagnés d’un échange de chaleur avec l’environnement. Plus la vitesse du changement chimique ou physique est élevée, plus le taux de production de chaleur est important. La calorimétrie isotherme est aujourd’hui une technique établie pour obtenir des informations sur un large éventail de phénomènes physiques, chimiques ou biologiques. Dans un microcalorimètre isotherme, l’évolution de la chaleur est surveillée en continu en temps réel, tandis que l’échantillon mesuré est maintenu à température constante.
La calorimétrie isotherme a été utilisée depuis plusieurs décennies pour surveiller l’autodécharge des batteries primaires essentiellement, comme celles utilisées dans les stimulateurs cardiaques, Hansen et Hart (1978). Au cours de la dernière décennie, une forte augmentation de l’intérêt porté à la microcalorimétrie a été observée en recherche et développement sur les batteries, à la fois dans les universités et l’industrie. Cette activité croissante s’est en grande partie concentrée sur les batteries secondaires, en particulier les cellules lithium-ion.
Le type de microcalorimètres généralement utilisé est le calorimètre à conduction de chaleur ou le calorimètre à flux de chaleur, équipé de récipients d’échantillon amovibles contenant l’échantillon de batterie à l’étude, voir Suurkuusk et coll. (2017) pour la description détaillée d’un système microcalorimétrique moderne. Les calorimètres sont assemblés dans un environnement hautement contrôlé, avec une stabilité de la température de l’ordre du μK. La chaleur étant produite ou absorbée par l’échantillon, l’énergie thermique circule entre l’échantillon et l’environnement du thermostat, maintenant la température de l’échantillon constante. Le flux de chaleur est mesuré par des capteurs thermoélectriques situés entre l’échantillon et son environnement à température contrôlée.
Ce contenu vise à fournir un aperçu de la microcalorimétrie isotherme dans le cadre de la recherche, du développement et du contrôle qualité des batteries, afin d’illustrer la polyvalence de la microcalorimétrie isotherme et de présenter ses possibilités.
PRODUCTION DE CHALEUR ET PROCESSUS DES BATTERIES
Lors de la charge ou de la décharge d’une batterie, de la chaleur est produite du fait de divers événements de production et de consommation de chaleur. Dahn et coll. (1985) ont étudié l’intercalation du Li à LixMo6Se8 dans une cellule électrochimique, par calorimétrie isotherme. Ils ont fourni un modèle qui considérait les diverses contributions à la production totale de chaleur pour une cellule lithium-ion rechargeable, illustré par les termes suivants :
PTotal = PPolarization + PEntropic + PParasitic (1)
Leurs travaux visaient à élucider le terme entropique réversible pour estimer expérimentalement le changement d’entropie du composé d’intercalation en fonction de la charge de lithium, x. L’objectif de leurs travaux était de valider expérimentalement les modèles gaz sur réseau théoriques d’intercalation.
Le terme polarisation, qui est exothermique, comprend tout processus responsable de la déviation de la tension de la cellule par rapport à la tension thermodynamique. Citons comme exemple le flux d’espèces chargées comme les électrons ou les ions dans la cellule. Le terme réversible représente le changement d’entropie de la cellule pendant la charge ou la décharge, par exemple les changements de l’état thermodynamique d’un matériau d’électrode selon le nombre d’ions lithium intercalés. Les réactions parasites sont généralement des changements irréversibles de la chimie de cellule qui limitent la durée de vie de la batterie. La quantité de chaleur produite du fait de ces réactions est une mesure directe du degré de limitation de la durée de vie d’une batterie par ces réactions.
Le modèle a plus tard été utilisé pour rationaliser une méthode de quantification des réactions parasites dans les cellules lithium-ion par microcalorimétrie isotherme, Krause et coll. (2012).
AUTODÉCHARGE
Les batteries en circuit ouvert tendent à générer des flux de chaleur de faible niveau du fait des processus d’autodécharge. L’autodécharge peut être définie comme la perte d’énergie qui réduit la durée de vie utile d’une batterie. Ceci est pertinent pour les batteries primaires. Les batteries secondaires subissent quant à elles également l’autodécharge, mais celle-ci est en partie irréversible, et en partie réversible lors de la recharge de la cellule. Bien que les mécanismes des processus d’autodécharge ne soient pas très bien compris pour de nombreux types de cellules, il est raisonnable d’émettre l’hypothèse que plus le taux de production de chaleur est élevé pour des types de batterie similaires, plus la durée de vie ou le cycle de recharge de la batterie est court(e).
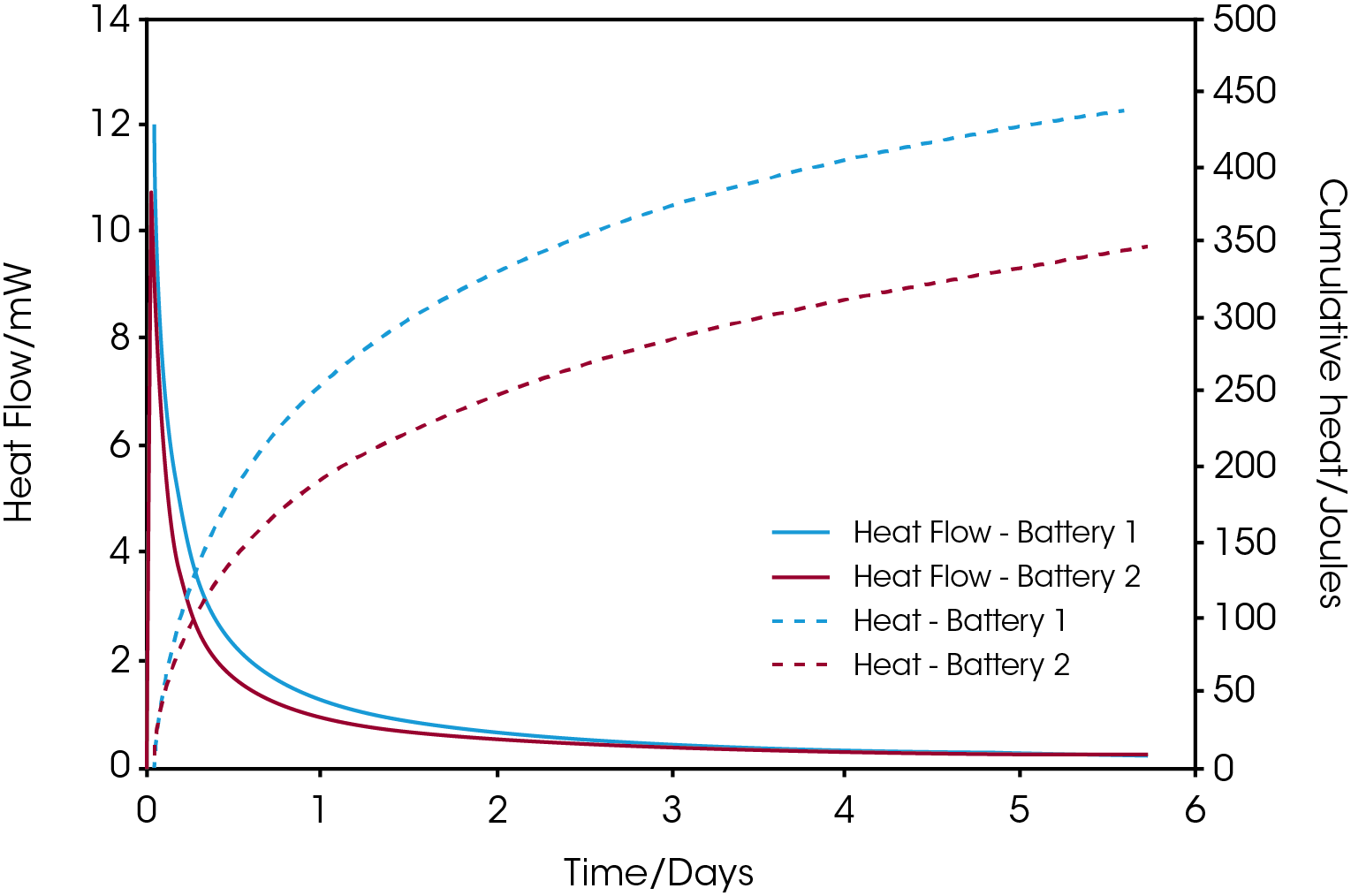
La Figure 1 illustre les courbes de flux de chaleur et de chaleur cumulée de l’autodécharge de batteries NiMH AAA de deux fabricants différents. Les batteries ont été chargées à 100 % avant d’être introduites dans le calorimètre à 25 °C. On observe que la batterie 1 présente un taux de décharge plus élevé pendant les 3 premiers jours, alors qu’au-delà, le flux de chaleur des deux batteries est environ le même. La différence d’énergie libérée entre les deux batteries après 5,7 jours est juste en dessous de 100 joules, comme le montrent les courbes de chaleur cumulée.
Roth (1999) a étudié l’autodécharge de cellules lithium-ions en fonction de la température, et l’état de charge (EDC) avec deux composés d’oxyde métallique d’intercalation de cathode. Une forte dépendance des processus d’autodécharge a été constatée avec l’EDC dans la plage 0-100 % et avec la température dans la plage 40-70 °C. Les mesures microcalorimétriques ont révélé une plus grande réactivité des cellules avec les cathodes LixNi0.8Co0.2O2 par rapport aux cathodes LixCoO2. En outre, une corrélation a été identifiée entre la propension à l’emballement thermique et le flux de chaleur mesuré, dans la plage de températures étudiée.
Hansen et Hart (1978) ont caractérisé les pertes de puissance interne des batteries des stimulateurs cardiaques en vue d’introduire une méthode d’assurance qualité rapide et fiable d’élimination des batteries qui présentent des taux d’autodécharge élevés. Ils ont différencié avec succès les batteries au taux d’autodécharge élevé de celles au taux faible, en testant les types de cellules MgO/Zn et Li-iode. Ils ont également remarqué que l’ancienneté de la batterie influence le flux de chaleur de l’autodécharge, ce qui nécessite une pondération des données calorimétriques à l’interprétation.
Aujourd’hui, il est possible de tester la qualité des batteries des stimulateurs cardiaques dans un microcalorimètre isotherme. Les tests sont souvent réalisés sur le dispositif médical, c’est-à-dire sur le stimulateur cardiaque lui-même. Le flux de chaleur d’un dispositif passif doit être très faible, inférieur à 20 μW et le plus souvent inférieur à 10 μW.
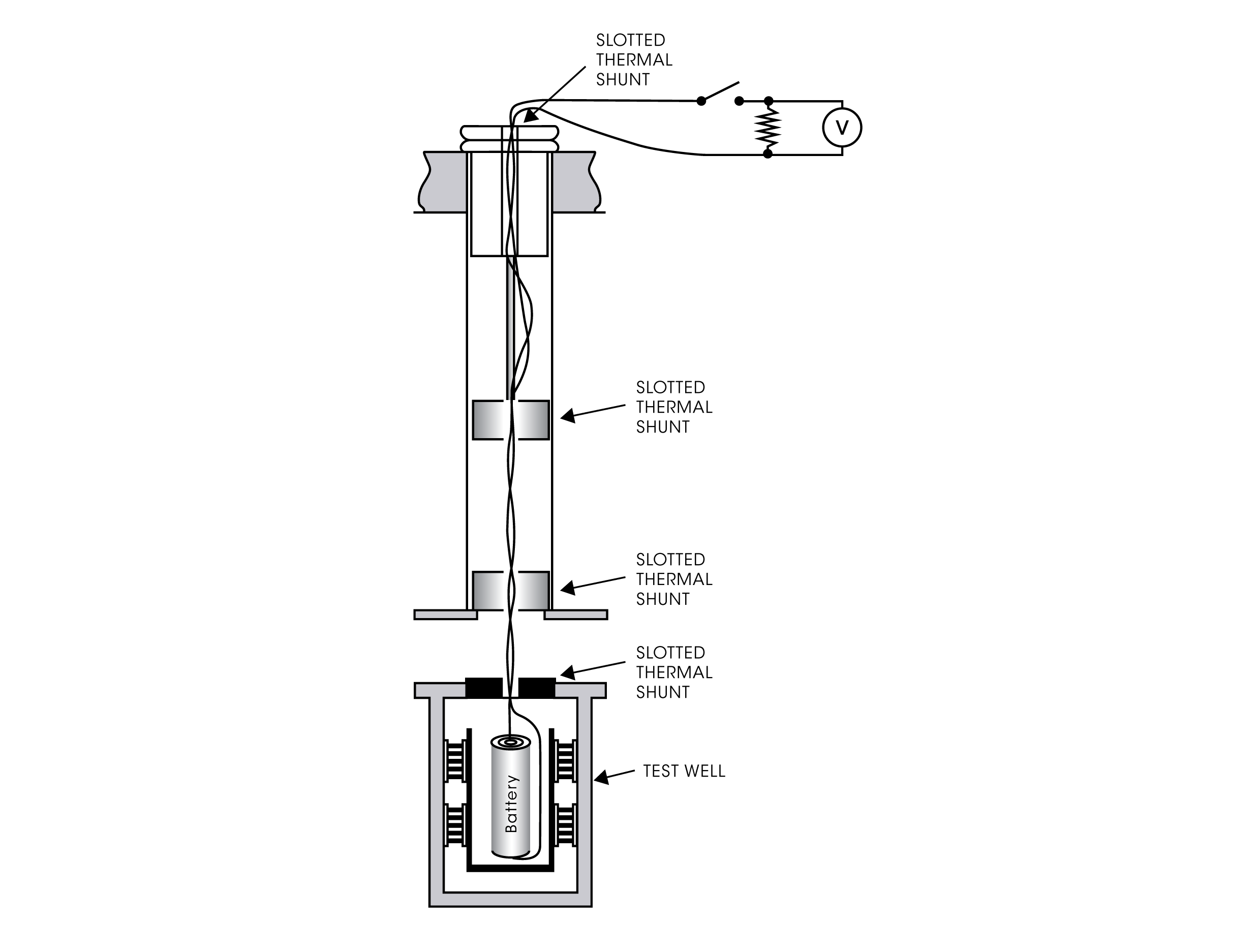
MESURES EN CIRCUIT FERMÉ
Les systèmes microcalorimétriques récents, comme le TAM IV ou le TAM XL, proposent plusieurs configurations expérimentales pour la mesure des processus des batteries en circuit fermé. Des ampoules spécialement conçues pour contenir la batterie ou tout autre échantillon électronique permettent la connexion des conducteurs électriques. Les fils sont sortis du calorimètre pour connexion à un dispositif électronique placé à l’extérieur, par exemple une résistance et/ou un autre dispositif électronique, comme une source d’énergie, un voltmètre, etc. Ici, la production de chaleur dans la batterie peut être mesurée pendant les cycles charge/décharge.
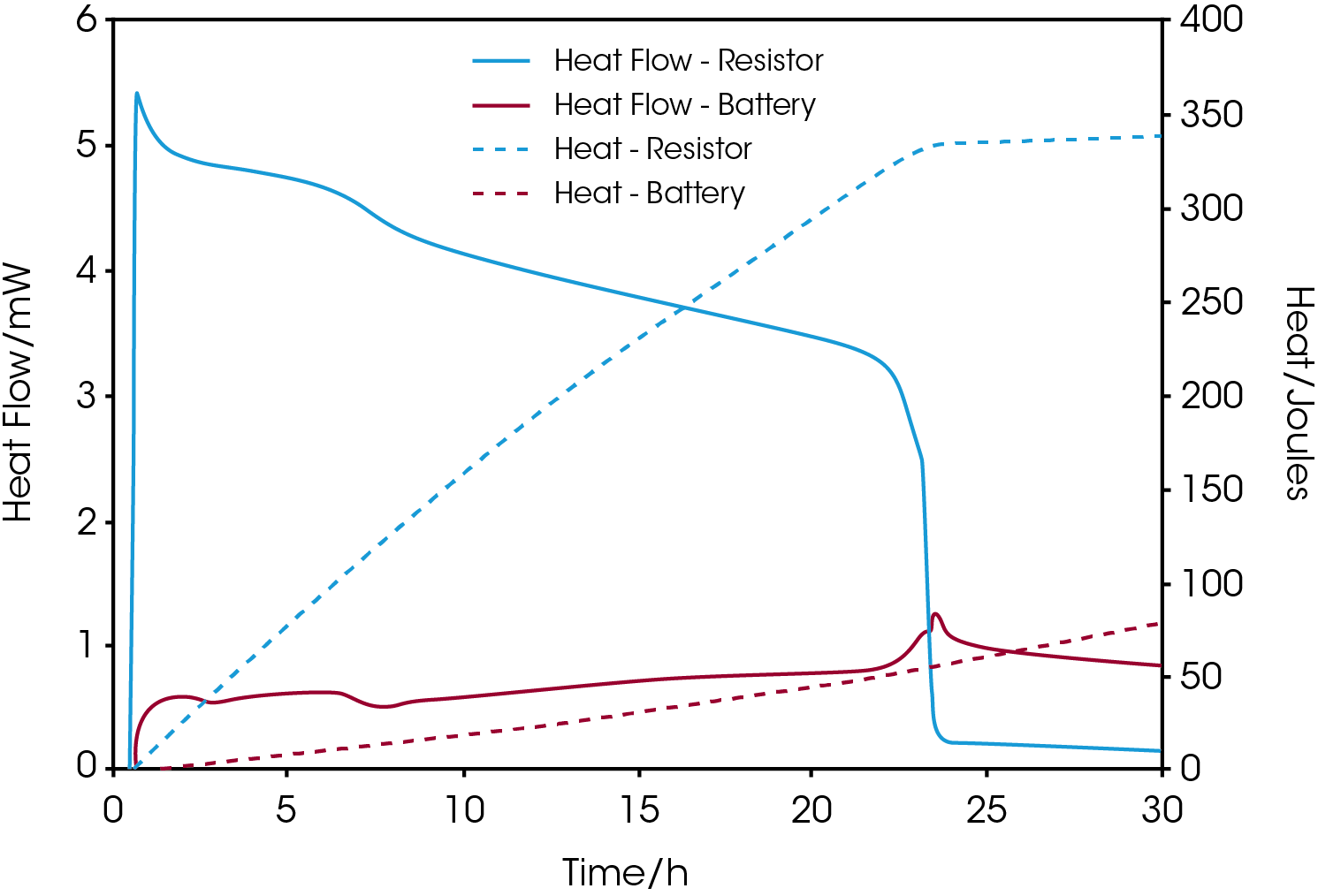
Une plateforme calorimétrique multicanal, comme le TAM IV, permet d’utiliser plusieurs calorimètres simultanément et indépendamment pour mesurer le flux de chaleur d’un dispositif électronique, comme une résistance, en plus de celui de la batterie. Ces mesures complètent le bilan énergétique en termes de production de chaleur. La Figure 3 illustre le flux de chaleur et la chaleur cumulée obtenus par les mesures réalisées sur une cellule bouton d’oxyde d’argent commerciale connectée à une résistance de 380 ohms placée dans un deuxième calorimètre.
Comme le courant qui traverse la résistance diminue au fil du temps lorsque la tension chute, une augmentation concomitante de la production de chaleur de la batterie est observée sur les graphiques. Lorsque le flux de chaleur de la résistance chute et approche zéro après environ 23 heures de mesures, la quantité totale de chaleur libérée est d’environ 330 joules, soit une valeur énergétique résiduelle de 75 mAh.
Le terme « calorimétrie électrochimique » a été adopté pour décrire l’association de la microcalorimétrie isotherme à un voltmètre haute résolution et à une source de courant de précision pour les études des cycles charge/décharge à différents états de charge, Krause et al. (2012). En plus de corréler les données calorimétriques avec les efficacités coulombiques, ces configurations expérimentales permettent de séparer et de quantifier les différentes contributions au flux de chaleur total, selon l’équation 1.
RÉACTIONS PARASITES
Krause et coll. (2012) ont décrit une méthode qui permet de séparer les événements de chaleur parasite de la production totale de chaleur, et ainsi de quantifier les réactions parasites. L’approche consistait à mesurer les cycles charge/décharge complets. La contribution de la polarisation a été obtenue à partir de l’hystérésis de tension intégrée et a alors pu être soustraite du flux de chaleur mesuré sur un cycle charge/décharge complet. En constatant que le flux de chaleur réversible d’un cycle s’annule à l’intégration sur le cycle complet, la chaleur restante est le résultat des réactions parasites irréversibles après soustraction de la contribution des effets de la polarisation. Ils ont identifié des corrélations linéaires entre la chaleur parasite et la quantité de lithium actif perdu, ce qui a permis de déterminer le changement d’enthalpie pour les réactions parasites, estimé dans ce cas à -212 kJ mol-1. L’énergie parasite s’est révélée supérieure avec une électrode de graphite de plus grande surface comparée à une électrode de surface moins grande.
Downie et coll. 2013 ont couplé un microcalorimètre TAM à un cycleur de batterie pour étudier de manière qualitative l’effet d’un additif d’électrolyte sur la stabilité de cellules « pochette » LiCoO2/graphite sur une plage de tensions définie. Les cycles charge/décharge à faible courant ont été mesurés en faisant varier la quantité de carbonate de vinylène tout en maintenant les autres paramètres des cellules identiques. Toute différence de flux de chaleur entre les cellules contenant l’additif et la cellule de contrôle sans additif a alors pu être attribuée à l’effet de l’additif. L’impact sur le flux de chaleur a été nettement observé ; plus la concentration était élevée, plus le flux de chaleur était faible, indiquant une augmentation de la stabilité. Il a également été conclu qu’au-delà d’une certaine concentration (2 %), l’additif présentait uniquement un effet supplémentaire léger sur la stabilité, ce qui permettait d’estimer la concentration optimale de carbonate de vinylène dans l’électrolyte.
ÉVOLUTIONS STRUCTURALES
Lors de la charge, des ions lithium quittent l’électrode positive pour venir s’intercaler dans l’électrode négative. Ceci modifie la structure cristalline, ce qui affecte l’entropie configurationnelle, et se détecte dans le signal de flux de chaleur, le second terme de l’équation 1. Si le processus est réversible, le signal de la charge et celui de la décharge s’annulent. Toutefois, l’entropie configurationnelle présente parfois une composante plus forte dans le signal de flux de chaleur, corrélée au dépôt de lithium, un événement difficile à détecter par les méthodes électrochimiques. Downie et coll. (2013).
Les données de flux de chaleur isotherme ont également révélé des comportements des matériaux inattendus, comme la cristallisation. Les événements de cristallisation génèrent un événement exothermique très marqué à peine perceptible par les méthodes électrochimiques. Chevrier et coll. (2021).
ÉVALUATIONS DE LA SÉCURITÉ
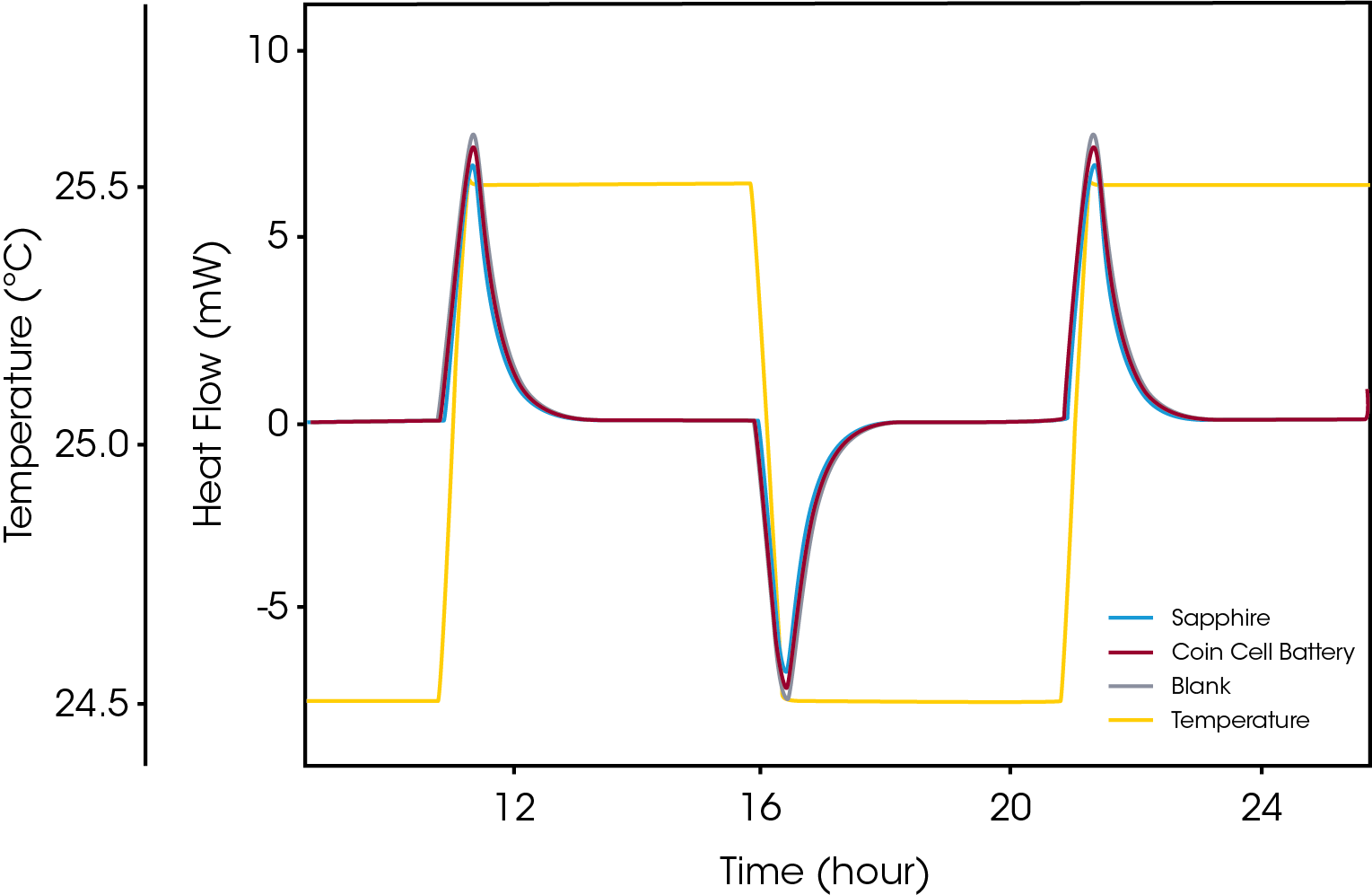
Le stockage de l’énergie chimique à haute densité est généralement associé à des risques de sécurité du fait de la possibilité de décomposition exothermique, susceptible d’entraîner des réactions d’emballement qui peuvent provoquer un incendie ou une explosion. Au même titre que le stockage de matériaux de haute énergie comme les explosifs, les batteries présentent ces risques, par exemple du fait que l’on cherche à augmenter la valeur énergétique des cellules lithium ion et que la forme réduite du lithium soit très réactive. Le taux de production de chaleur dans le matériau est en soi un paramètre essentiel lors de l’évaluation des éventuelles situations d’emballement de la température. La microcalorimétrie est une technique éprouvée pour ces évaluations, car elle s’applique à un éventail de matériaux de haute énergie. Outre le taux de production de chaleur, l’estimation de l’augmentation de température d’une batterie à divers états de charge lors des situations de charge et décharge requiert la détermination fiable des propriétés thermiques des batteries entières. La capacité thermique de la batterie est une propriété qu’il est possible de déterminer avec précision par microcalorimétrie. La Figure 4 illustre une mesure « isotherme par étape » typique d’une batterie entière.
Conclusions
Avec le développement d’instruments microcalorimétriques hautement polyvalents présentant des limites de détection proches du nanowatt, l’intérêt porté sur les mesures calorimétriques grandit pour la recherche, le développement et le contrôle qualité des batteries. La gamme de récipients de mesure aux formes et tailles variées permet d’effectuer des mesures en circuit ouvert ou fermé sur des batteries entières de différentes formes : bouton ; cylindrique AA, AAA et 18650 ; et « pochette ».
La limite de détection des calorimètres TAM IV les plus sensibles permet de mesurer des taux d’autodécharge faibles dans les plus petites batteries bouton ou le flux de chaleur des cycles charge/décharge à très faible courant.
Avec une source de courant et un voltmètre, ou un cycleur de batterie commercial, il est facile de déterminer de manière quantitative les réactions parasites en fonction de la tension, de la température et de la chimie de batterie.
La polyvalence du système TAM permet de concevoir plusieurs configurations expérimentales, dont les seules limites sont l’imagination ou la créativité du chercheur.
RÉFÉRENCES
1. Chevrier et al (2021) Isothermal Calorimetry Evaluation of Metallurgical Silicon as a Negative Electrode Material for Li-Ion Batteries, J. Electrochem. Soc. 168
2. Downie (2013) The Impact of Electrolyte Additives Determined Using Isothermal Microcalorimetry, ECS Electrochemistry Letters, 2 (10)
3. Downie (2013) In Situ Detection of Lithium Plating on Graphite Electrodes by Electrochemical Calorimetry, Journal of The Electrochemical Society, 160 (4)
4. Hansen, L.D., and Hart (1978) The characterization of internal power losses in pacemaker batteries by calorimetry, J. Electrochem. Soc.: Electrochemical science and technology 125(6).
5. Krause, L. J., Jensen, L. D., and Dahn, J. R. (2012) Measurement of parasitic reactions in Li-ion cells by electrochemical calorimetry, J. Electrochem. Soc 159 (7).
6. Roth, E. P. (1999) Thermal Stability of Li-Ion Cells, United States. https://www.osti.gov/servlets/purl/14010.
7. Suurkuusk, J., Suurkuusk, M., and Vikegard, P. (2017) A multichannel microcalorimetric system: The third generation thermal activity monitor (TAM III), J. Therm. Anal. Calorim. 131.
REMERCIEMENTS
This paper was written by Peter Vikegard, Ph.D., Applications Support at TA Instruments.
For more information or to request a product quote, please visit www.tainstruments.com/sales-contact to locate your local sales office information.
Cliquez ici pour télécharger la version imprimable de cette note d’application.

